
近日,厦门大学附属第一医院核医学科陈皓鋆团队在肿瘤学顶级期刊《Clinical Cancer Research》(JCR Q1区,IF=11.5)正式发表了题为“![]() Fibroblast Activation Protein-Targeted Radioligand Therapy with 177Lu-EB-FAPI for Metastatic Radioiodine Refractory Thyroid Cancer: First-in-Human, Dose-Escalation Study”的临床研究。该项研究首次评价了177Lu标记经伊文氏蓝(EB)修饰的长半衰期
Fibroblast Activation Protein-Targeted Radioligand Therapy with 177Lu-EB-FAPI for Metastatic Radioiodine Refractory Thyroid Cancer: First-in-Human, Dose-Escalation Study”的临床研究。该项研究首次评价了177Lu标记经伊文氏蓝(EB)修饰的长半衰期![]() 成纤维细胞激活蛋白配体EB-FAPI(177Lu-LNC1004)在手术无法切除且经酪氨酸激酶抑制剂(TKI)治疗后仍进展的转移性碘难治性甲状腺癌患者中的应用,其主要研究目的为探索177Lu-LNC1004的剂量学、安全性及初步疗效。厦门大学附属第一医院核医学科&闽南PET中心付浩、黄劲雄
成纤维细胞激活蛋白配体EB-FAPI(177Lu-LNC1004)在手术无法切除且经酪氨酸激酶抑制剂(TKI)治疗后仍进展的转移性碘难治性甲状腺癌患者中的应用,其主要研究目的为探索177Lu-LNC1004的剂量学、安全性及初步疗效。厦门大学附属第一医院核医学科&闽南PET中心付浩、黄劲雄![]() 及新加坡国立大学赵天智博士为该论文的共同第一作者;厦门大学附属第一医院核医学科&闽南PET中心的陈皓鋆教授,
及新加坡国立大学赵天智博士为该论文的共同第一作者;厦门大学附属第一医院核医学科&闽南PET中心的陈皓鋆教授,![]() 新加坡国立大学的陈小元、张静静教授为该项工作的通讯作者。厦门大学附属第一医院核医学科&闽南PET中心为该论文的第一单位及最后通讯单位。
新加坡国立大学的陈小元、张静静教授为该项工作的通讯作者。厦门大学附属第一医院核医学科&闽南PET中心为该论文的第一单位及最后通讯单位。
背景介绍
成纤维细胞激活蛋白(FAP)异常表达于肿瘤微环境中的癌相关成纤维细胞,已被认为是肿瘤显像和治疗的潜在重要靶点。近年来,各种放射性核素标记的喹啉类FAP抑制剂(FAPIs)已被开发,在用于FAP阳性肿瘤显像的同时,也已成功用于靶向肿瘤的放射配体治疗(Radioligand Therapy, RLT)。通过对FAPIs结构进行直接修饰,提高肿瘤摄取和滞留,同时减少在非靶组织中的聚集,是开发治疗性放射性药物的最佳方法。然而,目前靶向FAP的小分子药物在肿瘤中滞留时间较短,限制了其在肿瘤治疗方面的应用,且FAPI-04/46等小分子抑制剂的生物半衰期与常用的治疗性放射性核素镥-177(177Lu)的物理半衰期(6.7 day)并不匹配。
由于生物活性药物与白蛋白之间的偶联是可逆的,加之白蛋白在血浆中含量较多,因此白蛋白-药物复合物作为药物储存库增强了药物分布和生物利用度。伊文思蓝(EB)是一种有前景的白蛋白结合基团,靶向分子与EB衍生物偶联后其血液循环时间显著延长,进而提升了药物在肿瘤中的滞留时间。近期,一些EB修饰的FAPI (EB-FAPI)放射性药物在临床前研究中表现出了较FAPI-04/46更为显著的抑肿瘤效果(Wen et al. Theranostics. 2022;12(1):422-433; Jacopo Millul et al. Eur J Nucl Med Mol Imaging. 2023;50(10):3050-3061.)。
5-15%的分化型甲状腺癌(DTC)以及50%的转移性DTC(mDTC)最终将会发展为碘难治性DTC(RAIR-DTC),恶性程度较高;此外,甲状腺髓样癌(MTC)起源于神经内分泌来源的滤泡旁C细胞,约占所有甲状腺癌的2%;甲状腺未分化癌(ATC)是一种高度侵袭性的恶性肿瘤,确诊后的平均生存时间仅6个月。以上这些肿瘤因无法摄取放射碘(131I)而无法从131I治疗中获益,成为碘难治性甲状腺癌(RAIR-TC)。对于疾病进展期的转移性RAIR-TC(mRAIR-TC),酪氨酸激酶抑制剂(TKI)是目前标准的治疗策略;但对于TKI治疗后病情仍进展的患者,其临床治疗存在巨大挑战。我们前期研究通过![]() 68Ga-FAPI-46 PET/CT证实了大多数的mRAIR-TC肿瘤病灶对68Ga-FAPI-46呈现出高度摄取(Fu et al. Radiology. 2022;304(2):397-405.)。因此,靶向FAP的放射配体治疗(RLT)策略对于晚期mRAIR-TC的治疗可能具有一定的应用前景。
68Ga-FAPI-46 PET/CT证实了大多数的mRAIR-TC肿瘤病灶对68Ga-FAPI-46呈现出高度摄取(Fu et al. Radiology. 2022;304(2):397-405.)。因此,靶向FAP的放射配体治疗(RLT)策略对于晚期mRAIR-TC的治疗可能具有一定的应用前景。
本项研究中,我们探讨了一种新型靶向FAP的治疗性放射性药物177Lu-EB-FAPI(177Lu-LNC1004)在TKIs治疗后进展mRAIR-TC患者中的临床应用,主要研究目的包括177Lu-LNC1004的安全性、耐受性、剂量学和初步疗效评价。
研究设计思路
纳排标准:在该研究中,纳入了①病理确诊的mTC患者(包括DTC、MTC及ATC),其中DTC患者基于131I治疗结果被判定为mRAIR-DTC;②肿瘤无法进行手术切除;③TKIs治疗后疾病进展;④68Ga-FAPI PET/CT提示显像剂在肿瘤显著浓聚(超过50%的病灶SUVmax≥10)。血肌酐>150μmol/L;血红蛋白<8.0 g/dL;白细胞<2.0×109/L;血小板 <50×109/L;总胆红素>3倍上限制,白蛋白<2.0 g/dL;心功能不全;幽闭恐惧症;怀孕或哺乳期的患者排除出该研究。
研究过程:该研究设计为经典的3+3剂量递增模式(图1),每周期的治疗时间间隔为6周,药物起始剂量根据既往EB衍生药物研究(EB-PSMA、EB-TATE)设定为2.22 GBq(60mCi),后续队列按照50%的剂量递增直至出现剂量限制毒性(DLT)。同组不超过1/6例患者出现DLT时,该组所对应的最高剂量即为最大耐受剂量(MTD)。不良事件(AE)根据CTCAE5.0进行评估,DLT被定义为任何与![]() 177Lu-EB-FAPI治疗相关的3级(G3)以上的AE。研究主要终点包括177Lu-EB-FAPI在mRAIR-TC患者中的安全性及MTD,次要终点包括药物的剂量学参数及初步的抗肿瘤疗效。
177Lu-EB-FAPI治疗相关的3级(G3)以上的AE。研究主要终点包括177Lu-EB-FAPI在mRAIR-TC患者中的安全性及MTD,次要终点包括药物的剂量学参数及初步的抗肿瘤疗效。
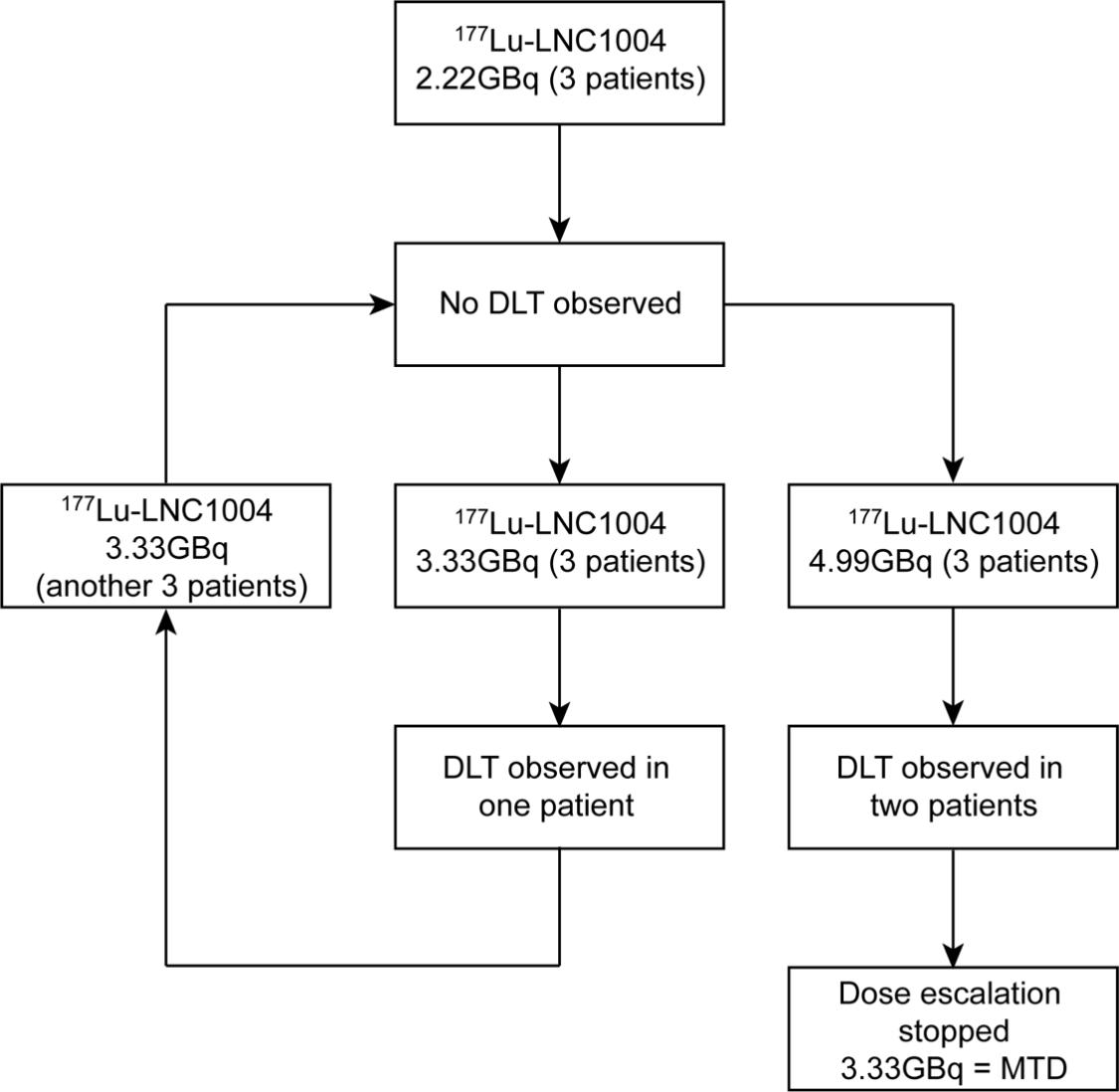
图1. ![]() 应用177Lu-LNC1004进行经典3+3剂量递增研究设计的流程图
应用177Lu-LNC1004进行经典3+3剂量递增研究设计的流程图
研究结果分析
患者临床特征见表1,根据该研究的纳排标准,8位男性及4位女性最终进入本研究:其中3例患者![]() 接受治疗剂量为2.28±0.10 GBq/Cycle,6例患者接受治疗剂量为3.50±0.09 GBq/Cycle,3例患者接受治疗剂量为4.80±0.28 GBq/Cycle。患者注射177Lu-LNC1004后未观察到危及生命的不良事件及药物反应,也未观察到与不良事件相关的即时生命体征或实验室检查结果的显著变化。其中,患者4(B组)在药物注射后1小时(h)开始出现颈部淋巴结及右锁骨转移灶肿胀,持续数天后在第7天逐渐缓解,伴随右锁骨转移灶坏死及出血;患者5和6(B组)在治疗后隔日骨转移灶出现疼痛加剧,患者5的骨痛持续1周后逐渐缓解,期间需服用非甾体类镇痛药;患者8(B组)自述治疗后体力和生活质量有所改善。
接受治疗剂量为2.28±0.10 GBq/Cycle,6例患者接受治疗剂量为3.50±0.09 GBq/Cycle,3例患者接受治疗剂量为4.80±0.28 GBq/Cycle。患者注射177Lu-LNC1004后未观察到危及生命的不良事件及药物反应,也未观察到与不良事件相关的即时生命体征或实验室检查结果的显著变化。其中,患者4(B组)在药物注射后1小时(h)开始出现颈部淋巴结及右锁骨转移灶肿胀,持续数天后在第7天逐渐缓解,伴随右锁骨转移灶坏死及出血;患者5和6(B组)在治疗后隔日骨转移灶出现疼痛加剧,患者5的骨痛持续1周后逐渐缓解,期间需服用非甾体类镇痛药;患者8(B组)自述治疗后体力和生活质量有所改善。
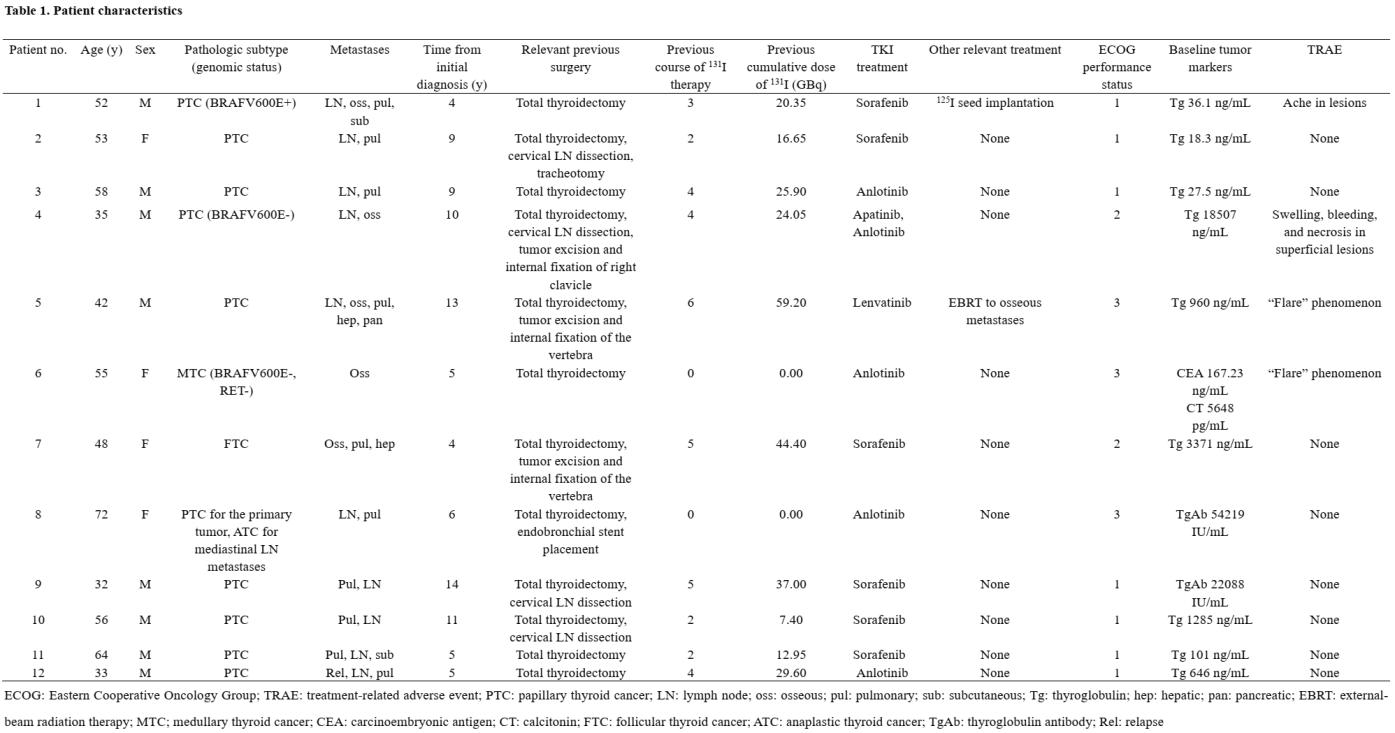
表1. 患者临床病理学特征
安全性结果显示,患者在接受177Lu-LNC1004治疗后均未发生肝肾毒性,但三组患者中均观察到一定的血液毒性(表2)。A组中,患者2在第一次RLT后6周发生了短期自限性G1血小板降低,第二次RLT后血小板降低再次出现的同时,也伴随了G1的白细胞降低及G2中性粒细胞降低;B组最初的3例患者中有2例也观察到血小板降低,其中1例为G4,因此该组额外新纳入3例患者,且新入组的3例患者中无G3以上的AE出现,致使药物剂量继续爬坡至更高的剂量水平。C组2例患者(患者12和10)在第1次及第2次RLT后分别出现G4和G3血小板减少,导致剂量递增终止。患者12同时也出现了G3白细胞降低和G4中性粒细胞降低,使其在第2次RLT前接受药物干预和后续治疗剂量降低。但其在第2次RLT后未观察到上述血液毒性发生。基于以上数据,未来177Lu-LNC1004临床试验的推荐剂量为3.33 GBq/Cycle。
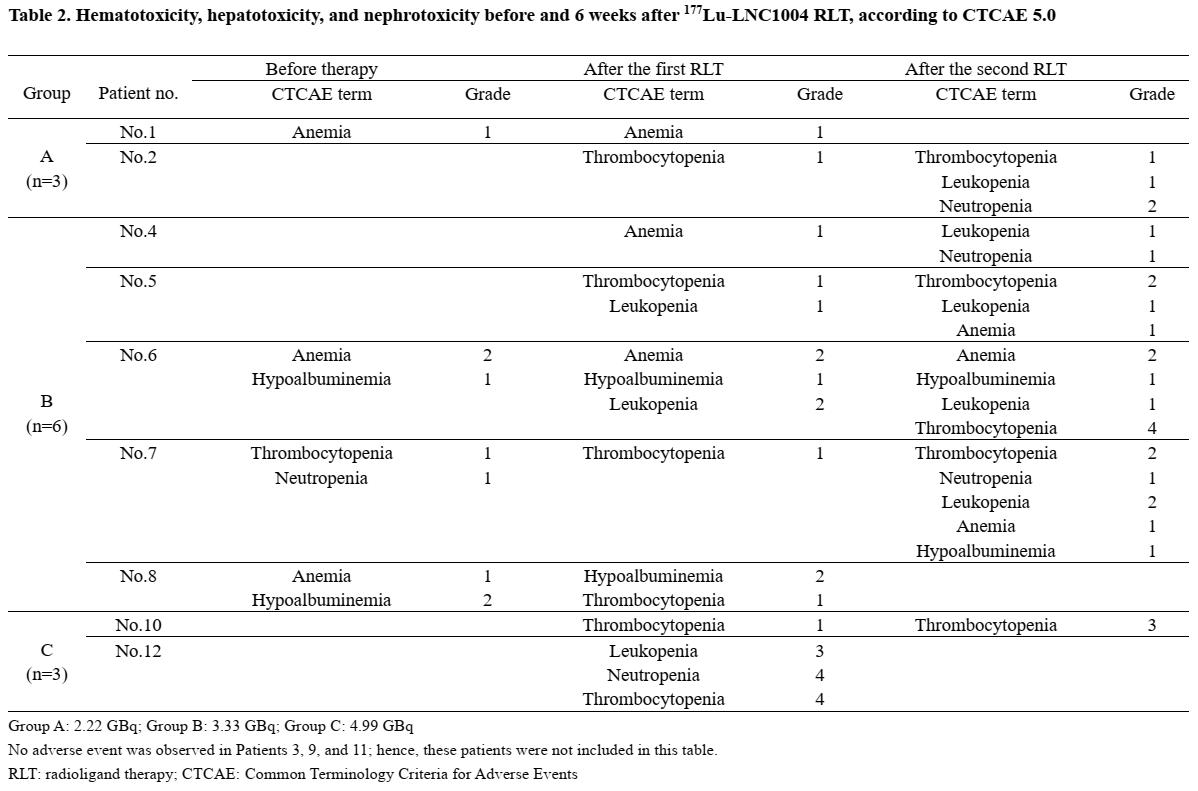
表2. 患者![]() 177Lu-LNC1004治疗前及治疗6周后血液、肝肾毒性评估
177Lu-LNC1004治疗前及治疗6周后血液、肝肾毒性评估
治疗后全身平面扫描提示177Lu-LNC1004注射后1h,心脏及大血管放射性浓聚,提示药物经注射后早起时间点主要聚集在血池内(图2)。在正常器官中,177Lu-LNC1004主要在肝、脾、肾脏中摄取,同时通过泌尿系统排泄;注射后1h的平面图中,肿瘤病灶即可清晰显示。除去血池中的摄取外,177Lu-LNC1004体内生物分布与治疗前68Ga-FAPI-46 PET/CT基本一致。此外,治疗后的连续全身扫描提示,在治疗后7天177Lu-LNC1004在肿瘤内仍有显著的摄取及滞留。
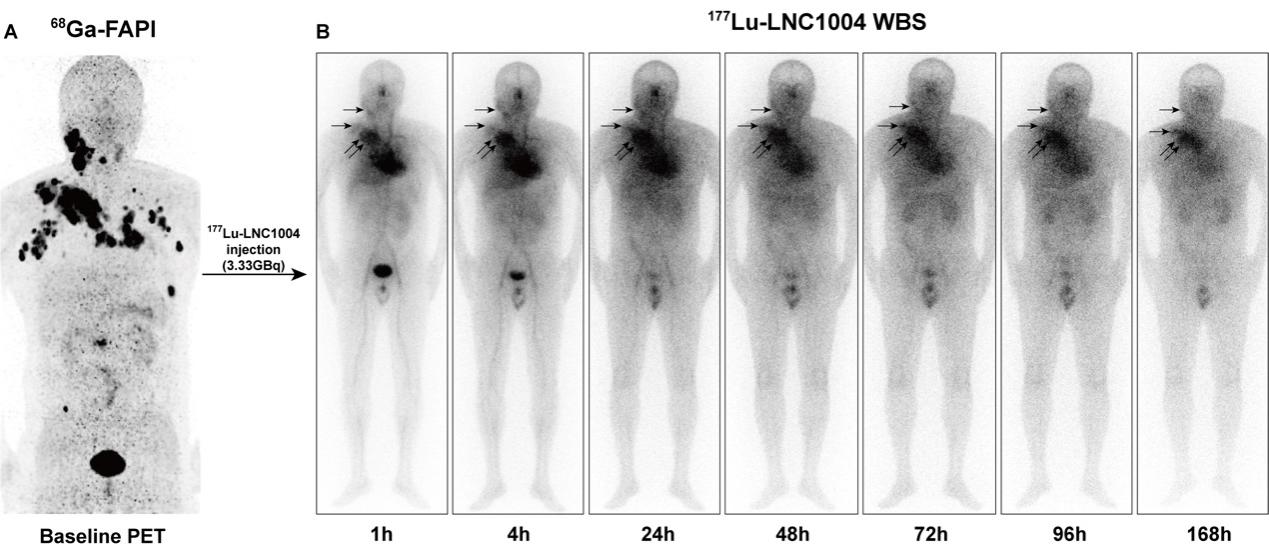
图2. (A)![]() 一例36岁mRAIR-DTC男性患者因疾病进展开始接受TKIs(阿帕替尼)治疗,但TKI治疗后疾病持续进展。177Lu-LNC1004治疗前68Ga-FAPI-46 PET/CT提示病灶异常浓聚。(B)注射3.33 GBq 的177Lu-LNC1004后,治疗后的1-168h全身平面显像(WBS,前位)显示药物在病灶内异常浓聚(箭头),与68Ga-FAPI-46 PET/CT显像结果一致。
一例36岁mRAIR-DTC男性患者因疾病进展开始接受TKIs(阿帕替尼)治疗,但TKI治疗后疾病持续进展。177Lu-LNC1004治疗前68Ga-FAPI-46 PET/CT提示病灶异常浓聚。(B)注射3.33 GBq 的177Lu-LNC1004后,治疗后的1-168h全身平面显像(WBS,前位)显示药物在病灶内异常浓聚(箭头),与68Ga-FAPI-46 PET/CT显像结果一致。
包括全身、血池、肝、肾等靶器官及病灶在内的摄取百分比(% uptake)、有效半衰期、滞留时间及平均吸收剂量的剂量学结果通过HERMES软件系统计算获得。因患者在药物注射后至第1小时扫描时禁止排尿,因此初始总体的%uptake认定为100%。总体代谢曲线呈恒定速率下降。此外,血池及肝脏%uptake曲线在注射后1h至24h快速下降,随后下降逐渐减缓。肾脏%uptake摄取及下降速率相对较缓(图3A)。177Lu-LNC1004在全身、血池、肝、肾中的有效半衰期分别为90.20±7.68 h,74.35±6.28 h,82.73±6.64 h及101.00±6.40 h(图3B)。而177Lu-LNC1004在全身、血池、肝、肾中的滞留时间分别为123.65±13.85 h,6.37±2.36 h,5.52±1.89 h及2.43±0.98 h(图3C)。根据上述剂量学参数计算出全身、心脏、红骨髓、肝、肾的平均吸收剂量分别为0.17±0.02 mSv/MBq,0.82±0.38 mSv/MBq,0.11±0.03 mSv/MBq,0.29±0.13 mSv/MBq及1.32±0.69 mSv/MBq。177Lu-LNC1004在全身的有效剂量则为0.17±0.04 mSv/MBq(表3)。
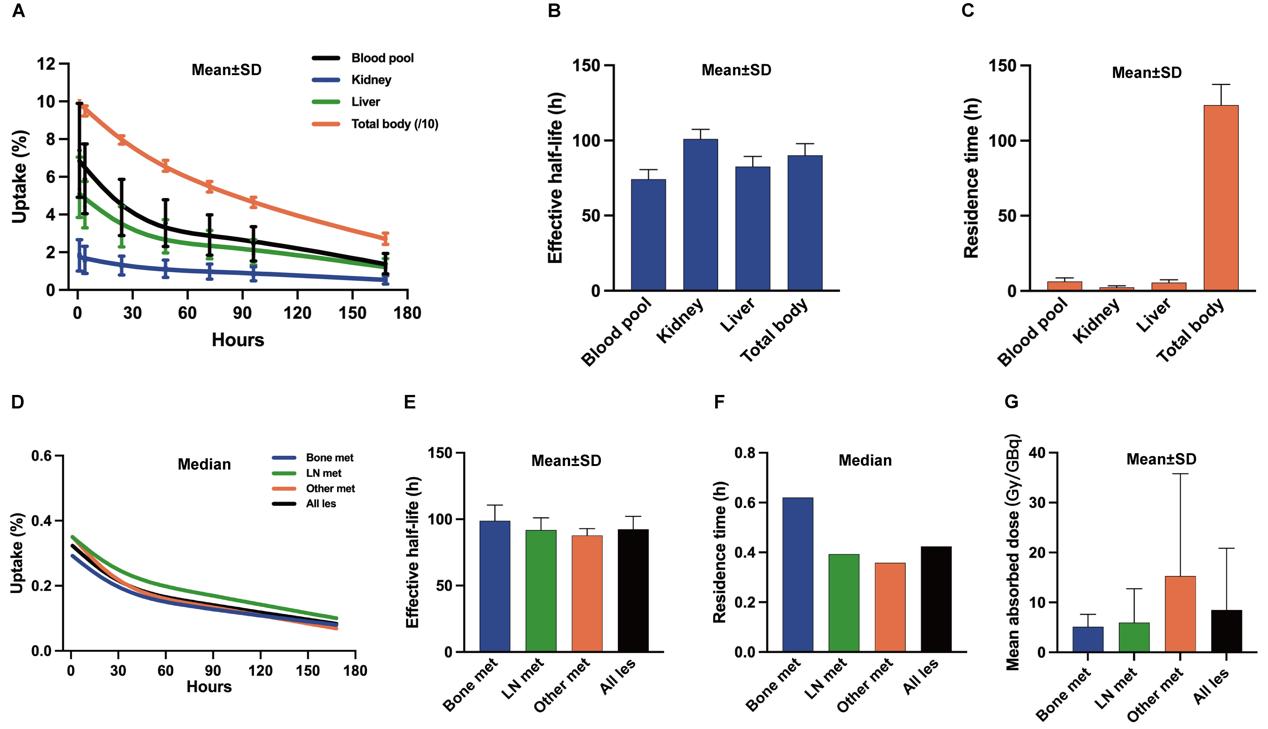
图3. 177Lu-LNC1004在患者的正常脏器及转移灶中的剂量学结果以及转移灶(骨、淋巴结和其他)的剂量学结果比较:(A)摄取占给药活度百分比(%uptake);(B)有效半衰期;(C)滞留时间(h);(D)药物在不同类型转移灶的%uptake;(E)药物在不同类型转移灶的有效半衰期(h);(F)药物在不同类型转移灶的滞留时间(h);(G)药物在不同类型转移灶中的吸收剂量。LN:淋巴结;met:转移灶;les:病变;Other:复发,皮下和内脏转移
对于肿瘤病灶而言,177Lu-LNC1004在所有病灶的初始%uptake为0.33%[0.22–0.70%],而在骨转移灶的%uptake (0.30% [0.22–0.71%])要低于淋巴结病灶 (0.37% [0.26–0.70%])及其他部位转移灶(0.37% [0.16–1.38%])。药物在病灶的廓清速率缓慢,近似于肾脏。177Lu-LNC1004在肿瘤病灶的有效半衰期为92.46±9.66 h,在骨转移灶的有效半衰期(98.82±11.89 h)要高于淋巴结病灶(91.77±9.27 h)及其他部位转移灶(87.77±5.12 h)。尽管177Lu-LNC1004在转移灶中的滞留时间(0.42 h [0.29–0.99 h])要短于其在上述正常脏器,但肿瘤病灶表现出最高的吸收剂量 (8.50±12.36 Gy/GBq) (range, 1.32-58.72Gy/GBq)。177Lu-LNC1004在骨、淋巴结、其他部位转移灶的滞留时间分别为0.62 h [0.38–2.73 h],0.39 h [0.25–0.93 h]及0.36 h [0.18–1.17 h],对应的吸收剂量分别为5.12±2.50 Gy/GBq (range, 2.31-7.62 Gy/GBq),5.95±6.80 Gy/GBq (range, 1.32-25.03 Gy/GBq)及15.27±20.52 Gy/GBq (range, 2.10-58.72 Gy/GBq)。
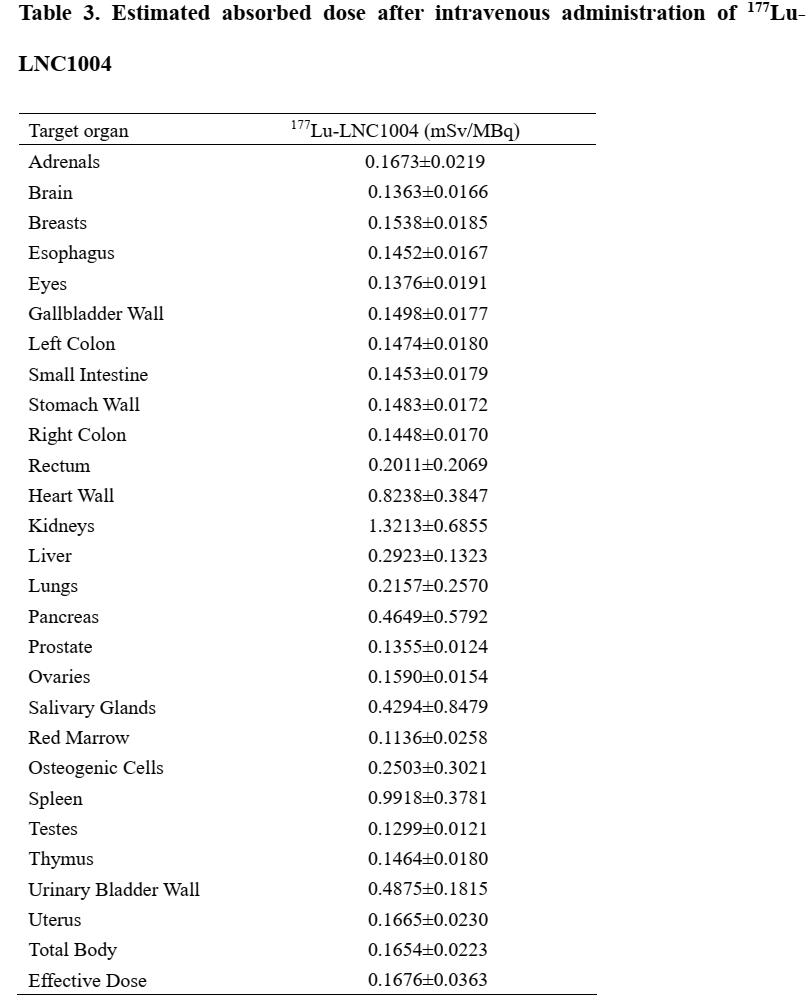
表3. 177Lu-LNC1004平均吸收剂量
患者在接受177Lu-LNC1004治疗后对周围的辐射剂量也进行了测量。三组患者在治疗后4h时1m线的平均照射量分别为5.95±0.32 μSv/h (A组),10.53±2.22 μSv/h (B组)及14.77±2.84 μSv/h (C组)。当患者在3m线时的平均暴露量则为1.38±0.16 μSv/h (A组),2.02±0.15 μSv/h (B组)及2.72±0.28 μSv/h (C组)(图4)。辐射剂量曲线随着时间延长逐渐降低,,三组患者在治疗后48h时1m及3m的平均暴露量分别为4.22±0.42 μSv/h (A组),7.00±1.34 μSv/h (B组),9.91±1.42 μSv/h (C组);1.09±0.18 μSv/h (A组),1.46±0.19 μSv/h (B组)及1.95±0.15 μSv/h (C组)。
所有的患者在第二轮RLT治疗后的第6周根据RECIST 1.1标准进行了初步疗效评价。3例患者(患者4、5、6)达到部分缓解(PR),7例患者疾病稳定(SD),客观反映率(ORR)及疾病控制率(DCR)分别为25%及83%(图5)。其中患者4的右锁骨病灶、肋骨病灶及淋巴结病灶在两次治疗后显著缩小,值得一提的是因左肺门淋巴结转移灶导致的阻塞性肺炎也得到了缓解(图6A)。在患者5中,靶病灶肝转移及非靶病灶的胸腔积液得到了缓解,同时骨、肺转移的靶病灶的最大径之和在两次次治疗后也显著缩小(图6B)。然而,患者1和8在两次RLT治疗后疾病仍出现进展。其中患者8的靶病灶最大径之和较前增大,患者1出现新发皮下转移灶。另外,177Lu-EB-FAPI治疗前后靶病灶在68Ga-FAPI-46 PET/CT的SUVmax变化率提示PR的患者显著降低,而PD的患者显著增高(图7)。

图5. 靶病灶最大直径之和与基线的最佳变化百分比(n=12)。PD:疾病进展;SD:病情稳定;PR:部分缓解
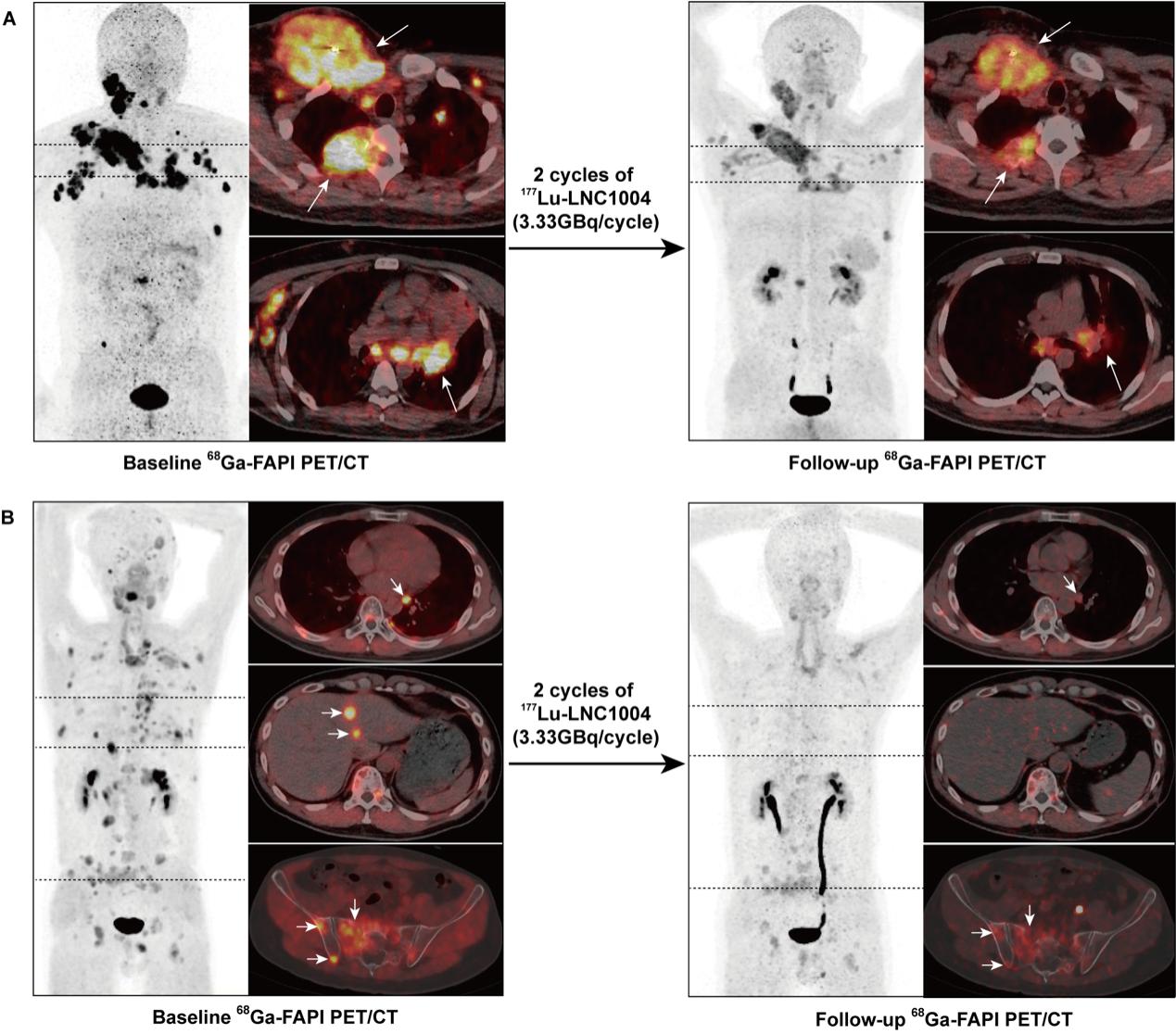
图6. (A) 一例36岁mRAIR-DTC男性接受TKIs治疗后疾病进展,接受177Lu-LNC1004 (3.3 GBq/周期)治疗。基线68Ga-FAPI-46 PET/CT显示,68Ga-FAPI-46在包括淋巴结、椎体和锁骨在内的大多数转移灶中(左,箭头)异常浓聚。同时可见左肺门转移淋巴结转移所致的阻塞性肺炎。2周期治疗后,68Ga-FAPI-46 PET/CT显示肿瘤大小缩小、放射性摄取显著降低,同时阻塞性肺炎显著缓解(右,箭头)。(B)一例42岁mRAIR-DTC男性TKI治疗后疾病进展,接受![]() 177Lu-EB-FAPI治疗(3.3 GBq/周期)。基线时68Ga-FAPI-46在骨转移、左肺门淋巴结和肝转移(左,箭头)中异常浓聚。经过2个周期的177Lu-LNC1004治疗后, 68Ga-FAPI-46 PET/CT显示转移灶的大小及范围显著缩小(肝脏病灶基本消失),放射性示踪剂摄取显著降低(右,箭头)
177Lu-EB-FAPI治疗(3.3 GBq/周期)。基线时68Ga-FAPI-46在骨转移、左肺门淋巴结和肝转移(左,箭头)中异常浓聚。经过2个周期的177Lu-LNC1004治疗后, 68Ga-FAPI-46 PET/CT显示转移灶的大小及范围显著缩小(肝脏病灶基本消失),放射性示踪剂摄取显著降低(右,箭头)
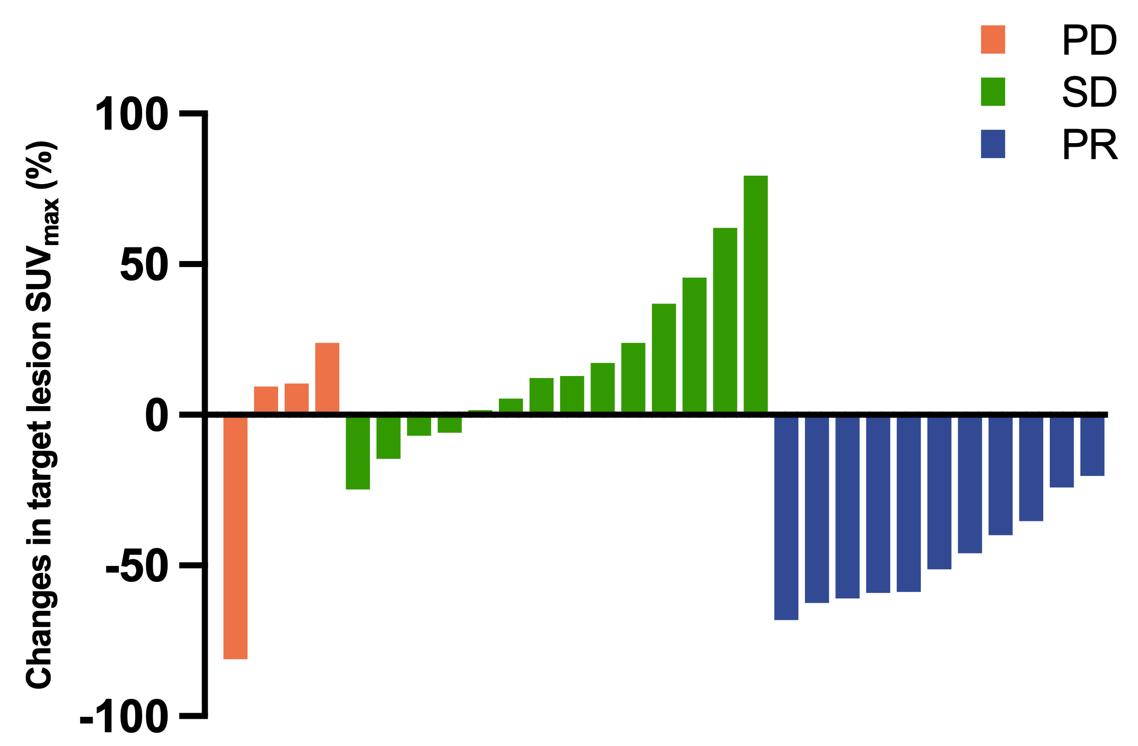
图7. 两个治疗周期前后靶病灶SUVmax的变化(lesion-based analysis)。PD:疾病进展;SD:病情稳定;PR:部分缓解
总结
本项研究首次验证了mRAIR-TC患者接受剂量递增177Lu-EB-FAPI(177Lu-LNC1004)放射配体治疗安全性、可行性的同时,也提供了177Lu-LNC1004在人体内的剂量学信息。总体而言,所有接受177Lu-LNC1004放射配体治疗的mRAIR-TC患者对177Lu-LNC1004耐受性良好,未见严重不良事件报告。此外,本研究还探索了177Lu-LNC1004在mRAIR-TC中的初步疗效,有望对晚期TKI治疗失败后的mRAIR-TC患者提供新的治疗策略。其抗肿瘤疗效有待将来大规模的前瞻性随机对照多中心临床研究报告。
主要作者介绍
通讯作者

陈皓鋆,厦门大学附属第一医院核医学科副主任医师,副教授,硕士生导师;第21届全国青年岗位能手,福建省卫健委高层次领军人才,厦门市“青年双百人才”;担任欧洲核医学会(EANM)会刊《Eur J Nucl Med Mol Imaging》编委、《中华核医学与分子影像杂志》编委;研究方向为核医学分子影像及核素诊疗一体化,侧重使用Ga-68标记探针进行肿瘤分子成像,使用β射线发射体Lu-177 标记的多肽或小分子进行放射性核素治疗。近5年以通讯/第一作者在权威期刊发表研究论著40余篇,其中14篇发表在《Clin Cancer Res》、《Radiology》、《J Nucl Med》。作为项目负责人主持包括国家自然科学基金、福建省杰出青年科学基金、福建省卫健委重大项目在内的多项科研课题,并作为主要研究者牵头临床研究8项。研究成果在2021-2022连续2次荣获欧洲核医学会“年度最佳论文奖”,北美核医学会(SNMMI)“杰出青年科学家奖”(SNMMI Ones to Watch, TOP 30)、SNMMI青年专家委员会“临床研究奖”第1名;2020年获中华医学会核医学分会“希望之星”奖,并以第一完成人获厦门市科技进步二等奖。
第一作者

付浩,厦门大学附属第一医院核医学科主治医师,福建省“海纳百川”高层次人才,厦门市高层次人才,中国医药教育协会核医学专业委员会委员,福建省海峡肿瘤防治科技交流协会委员,2020年毕业于上海交通大学医学院,先后师从核医学领域著名专家吴华教授,甲状腺癌诊疗领域著名专家陈立波教授。主攻碘难治性甲状腺癌分化治疗、碘难治性甲状腺癌靶向治疗、甲状腺癌放射性核素诊疗一体化,肿瘤放射性核素诊疗一体化。2022年获批福建省自然科学基金青创项目、2021年获批国家自然科学基金青年项目,2020年获批厦门市医疗卫生指导项目,参与多项国家自然科学基金面上项目。研究结果入选2023年SNMMI YIA,入选2022-2023年SNMMI及EANM口头汇报。以第一作者身份在《Clinical Cancer Research》、《Radiology》、《Endocrine-Related Cancer》、《Clinical Nuclear Medicine》、《Molecular Therapy Oncolytics》等多个杂志发表SCI论文14篇

黄劲雄,厦门大学附属第一医院核医学科主任、教授、硕士生导师。担任中华医学会核医学分会功能显像学组委员、中华医学会核医学分会治疗学组第一届放射性粒子介入工作委员会委员、中华医学会核医学分会心脏学组委员、美国核心脏病学会(ASNC)国际会员、中国抗癌协会肿瘤核医学专业委员会委员、中国抗癌协会肿瘤核医学专业委员会第一届治疗学组委员、全国高等学校八年制核医学配套教材编委、中国医药质量管理协会医学影像质量研究委员会核医学专业委员会委员、福建省医师协会核医学医师分会常委、福建省核医学质控中心委员、福建省医学会核医学分会委员、厦门市环境应急专家库成员、厦门市医学会第四届医疗事故暨医疗损害技术鉴定专家库成员、厦门市核学会理事。从事核医学临床工作20余年,擅长放射性核素治疗、SPECT/CT影像诊断,尤其对甲状腺癌诊治方面有独到的见解。主持及参与国家、福建省及厦门市科学基金数项,发表SCI及中华核心期刊10余篇。