今天为大家分享一篇近期发表在临床肿瘤学TOP期刊《Clinical Cancer Research》的研究,题目为 “68Ga-NK224 PET/CT for Non-Invasive Evaluation of PD-L1 Expression and
Inter-Tumor Heterogeneity: A Translational Exploratory Study”。在这篇文章中,研究团队开发了一种靶向PD-L1的新型环肽放射性探针68Ga-NK224,展示了其在非小细胞肺癌(NSCLC)患者中无创评估PD-L1表达并揭示瘤间异质性方面的临床转化潜力。本文的通讯作者是厦门大学附属第一医院的陈皓鋆教授、林勤教授、钟山教授,第一作者是厦门大学附属第一医院赵亮主治医师、逄一臻博士和丁毅副主任医师。
研究背景介绍
免疫检查点抑制剂(ICB)特别是针对PD-1/PD-L1通路的治疗策略,已显著改善多种恶性肿瘤患者的生存结局。PD-L1表达是目前指导免疫治疗的重要生物标志物,但传统组织活检存在取样局限,无法准确反映全身病灶及其动态变化,亟需一种无创、可重复、全身性的检测手段。
靶向PD-1及其配体PD-L1的免疫检查点抑制剂(ICB)已成为包括非小细胞肺癌(NSCLC)在内的多种恶性肿瘤治疗的重要基石之一。然而,如何精准筛选最可能获益的患者仍是临床面临的一大挑战。目前,PD-L1表达、肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)等生物标志物被用于指导免疫治疗,其中PD-L1肿瘤比例评分(TPS)是NSCLC中常用的生物标志物。尽管如此,PD-L1的表达水平与疗效并非完全一致,部分高表达患者疗效不佳,而低表达甚至阴性者亦可受益,提示传统组织活检存在取样局限,无法准确反映全身病灶及其动态变化,亟需一种无创、可重复、全身性的检测手段。
核医学分子影像,特别是PET技术,具备非侵入、全身覆盖和定量评估的特点,已成为靶向表达可视化的有力工具。尽管已有抗PD-L1抗体放射探针用于PET成像研究,但其成像时间长、成本高、免疫原性强等问题限制了临床推广。相比之下,小分子肽类探针具备快速清除、良好组织穿透性和高对比成像等优势,成为更具前景的替代选择。
本研究中,作者团队开发了一种特异性靶向PD-L1的环肽类分子探针NK224,使用NOTA螯合剂实现与68Ga/18F的高效标记,具有良好的体内分布性质及PD-L1靶向亲和力。在临床前系统评估的基础上,研究团队进一步完成了68Ga-NK224在NSCLC患者中的临床转化研究,探索其在PD-L1表达可视化、肿瘤异质性评估以及免疫治疗靶点占用监测中的应用潜力。
研究结果
68Ga/18F-NK224的体外性能评价
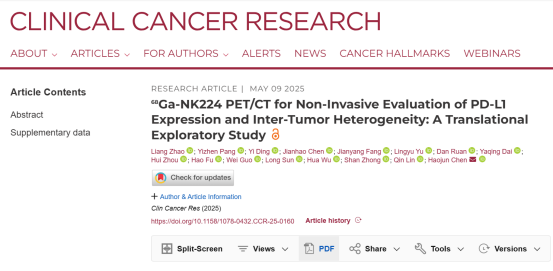
NK224是一种14个氨基酸的环状多肽,其序列为环- (Ac-Tyr-NMeAla-Asn-Pro-His-Glu-Hyp-Trp-Ser-Trp- NMeNle-NMeNle-Lys-Cys)-Gly-NH2,将NOTA作为螯合剂连接NK224,合成可用于18F和68Ga标记的靶向探针NK224(图1A)。放射性标记后的68Ga-NK224与18F-NK224比活度均达30 GBq/μmol以上,放射化学纯度≥99%,在PBS和FBS中2小时内保持高度稳定(图1B-C)。
在细胞水平,68Ga-NK224对PD-L1具有良好的结合亲和力(IC50 = 2.45 nM)(图1D)。在不同PD-L1表达水平的细胞系中(U87-MG > C666-1 > A549),探针摄取量与PD-L1表达呈高度正相关(图1E-G)。阻断实验显示,过量未标记NK224或PD-L1商品化抗体可使探针摄取降低90%以上,证实其特异性(图1E)。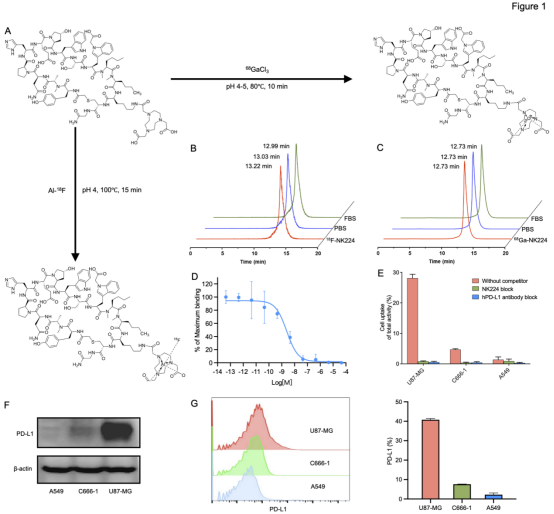
图1. 68Ga-NK224和18F -NK224的体外评价。(A) NK224的化学结构及其放射性标记示意图。(B-C) 68Ga-NK224和18F-NK224在PBS和FBS中的稳定性分析。(D) NK224与PD-L1的结合亲和力评估。(E) 68Ga-NK224在A549、C666-1和U87-MG细胞中的摄取与阻断实验。(F-G) A549、C666-1和U87-MG细胞中PD-L1表达水平的western blot和流式细胞术检测结果。
68Ga-NK224和18F-NK224的体内性能评价
在高表达PD-L1的U87-MG荷瘤小鼠模型中,68Ga-NK224显示了良好的体内分布及靶向特异性。小动物PET显像显示,注射后1小时和2小时,68Ga-NK224在肿瘤内的摄取与对照探针68Ga-WL12(已进入临床试验的PD-L1探针)相当,但在肝、肾、肺等正常器官的背景摄取显著更低,从而获得了更高的肿瘤/背景比(图2A)。当同时注射过量未标记的NK224或hPD-L1抗体后,肿瘤摄取显著降低,进一步验证了探针的PD-L1靶向特异性。离体组织生物分布结果与PET成像高度一致(图2B)。在相同动物模型中,使用18F标记的NK224也获得了与68Ga-NK224一致的肿瘤显像效果,在1-2小时内均可实现清晰成像,具备良好的肿瘤/背景比(图2C),展现跨放射性核素平台的一致性。为了进一步验证探针识别不同PD-L1表达水平的能力,研究使用了U87-MG(高表达)、C666-1(中表达)和A549(低表达)三种异种移植瘤模型。结果显示,68Ga-NK224的肿瘤摄取量与PD-L1表达量高度相关,呈现U87-MG > C666-1 > A549的趋势(图2D),与相应肿瘤组织的PD-L1免疫组化染色结果相符(图2E)。
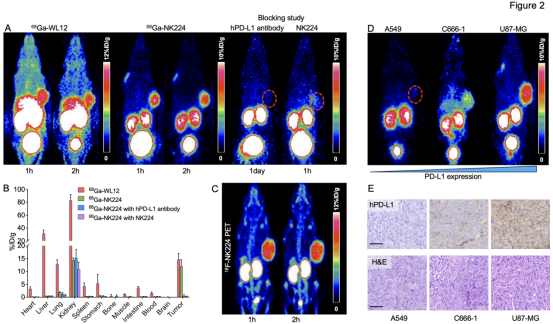
图2. 68Ga-NK224和18F-NK224的体内评价。(A) U87-MG肿瘤模型中使用68Ga-WL12和68Ga-NK224的代表性PET显像图像,以及68Ga-NK224的阻断实验图像;(B) U87-MG肿瘤模型中68Ga-WL12与68Ga-NK224的组织分布定量结果,包括68Ga-NK224的阻断实验数据;(C) U87-MG肿瘤模型中18F-NK224的代表性PET显像图像;(D) A549、C666-1和U87-MG荷瘤小鼠在注射后1小时的代表性PET图像,显示PD-L1特异性的肿瘤摄取情况;(E) 对应肿瘤组织的PD-L1免疫组化染色及H&E染色图像。
68Ga-NK224具有良好的体内分布性质和临床安全性
3名健康志愿者的剂量学分析显示,使用OLINDA软件计算的有效剂量为2.06E-02 mSv/MBq,符合核医学放射性探针的辐射安全标准。放射性示踪剂体内主要分布于脾脏和肝脏,未见其他脏器的异常浓聚(图3A-B)。2023年5月至2024年11月,团队开展了一项前瞻性临床转化研究,共纳入37例肺癌患者接受68Ga-NK224 PET/CT扫描,其中31例具备PD-L1免疫组化染色结果并纳入分析。无论是健康志愿者还是肺癌患者,注射后 4 小时内所有受试者均无不良反应,表现出良好临床安全性。
图3. 68Ga-NK224在3位健康志愿者体内的分布情况。(A)注射后15、30、60和120分钟的代表性PET成像,显示示踪剂在正常器官中的分布情况。(B)主要器官(包括肝脏、脾脏、肺部和肾脏)在注射后15、30、60和120分钟的SUVmean半定量分析。
NSCLC患者PD-L1表达与68Ga-NK224摄取高度相关,而与18F-FDG摄取无关
本研究纳入的31例肺癌患者中28例为初治患者接受PET/CT初始分期,3例用于评估肿瘤复发转移。26例患者获取了肺部肿瘤活检标本,6例获取了肺外转移灶标本(1例同时获取原发灶和骨转移灶标本)。根据PD-L1表达水平,11例为阴性表达(<1%),14例中表达(1-49%),7例高表达(≥50%)。PD-L1阴性、中、高表达组68Ga-NK224的SUVmax中位数(四分位距)分别为2.6(2.0-3.3)、4.3(3.7-4.9)和7.8(7.3-11.8)。18F-FDG摄取与PD-L1表达无相关性(图4A),而68Ga-NK224摄取与PD-L1表达呈显著正相关(图4B,p<0.001)。图4C展示了不同PD-L1表达水平患者的代表性68Ga-NK224 PET/CT图像及免疫组化染色结果。
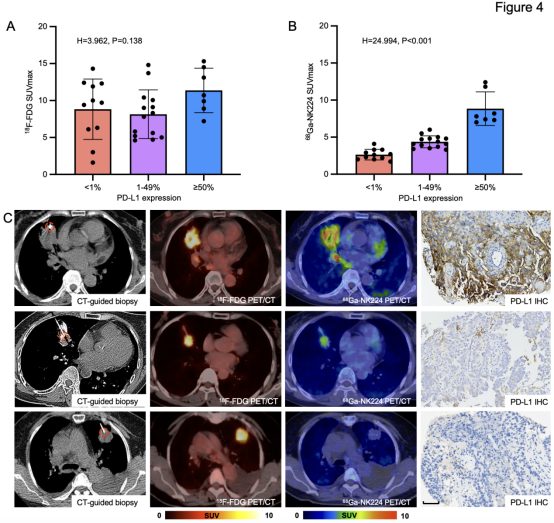
图4. 68Ga-NK224肿瘤摄取与PD-L1表达水平的相关性分析。(A-B)Kruskal-Wallis检验结果显示:18F-FDG SUVmax与PD-L1表达无显著相关性(P=0.138),而68Ga-NK224 SUVmax与PD-L1表达呈显著相关(H=24.994,P<0.001)。(C)不同PD-L1表达水平患者的18F-FDG与68Ga-NK224 PET/CT图像及对应免疫组化染色标本(红圈标示CT引导下活检部位)的代表性病例。上排:18F-FDG SUVmax 15.3,68Ga-NK224 SUVmax 8.2,PD-L1 TPS 80%;中排:18F-FDG SUVmax 10.1,68Ga-NK224 SUVmax 4.8,PD-L1 TPS 2%;下排:18F-FDG SUVmax 10.4,68Ga-NK224 SUVmax 2.2,PD-L1 TPS <1%。比例尺:50µm。
31例患者共检出31个肺部肿瘤和215个转移灶。肺部肿瘤与转移灶的68Ga-NK224 SUVmax中位数均为4.1(四分位距分别为3.3-4.9和2.6-5.8),组间无显著差异(p=0.709)。Spearman相关性分析显示246个肿瘤病灶的68Ga-NK224摄取与病灶大小无显著关联(p=0.187),提示其摄取更可能反映靶点表达而非肿瘤大小。为评估68Ga-NK224 PET/CT可视化肿瘤PD-L1表达异质性的能力,研究者分析了同一患者不同病灶的摄取差异。图5A展示典型病例:肺部原发灶(PD-L1低表达,SUVmax 5.0)与骨转移灶(PD-L1高表达,SUVmax 11.8)的68Ga-NK224摄取差异显著,而二者18F-FDG摄取相近(原发灶SUVmax 7.8,骨转移灶8.6)。31例患者中24例存在多发性转移灶,这些患者病灶间68Ga-NK224 SUVmax的中位变异系数(CV)达27.5%(范围5.7%-53.2%)。为进一步评估68Ga-NK224 PET/CT在识别患者体内PD-L1表达异质性方面的能力,通过数据可视化展示了每位患者不同病灶之间的探针摄取差异(图5B)。
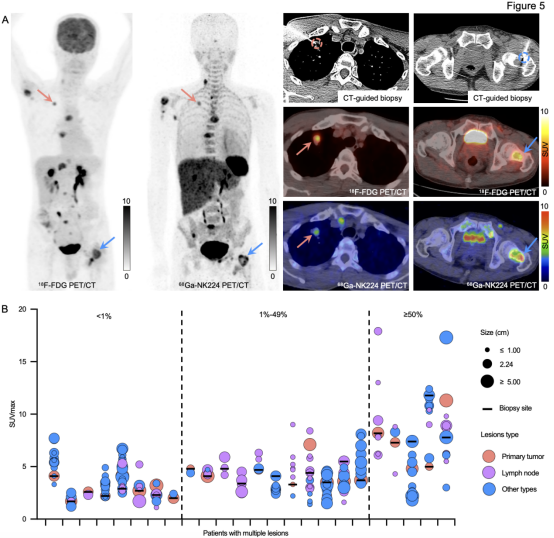
图5. 68Ga-NK224 PET/CT可视化患者内PD-L1表达异质性。(A)转移性NSCLC患者的代表性PET/CT图像:18F-FDG在原发灶(红色箭头,SUVmax 7.8)与骨转移灶(蓝色箭头,SUVmax 8.6)摄取相似;68Ga-NK224在两者摄取差异显著(原发灶SUVmax 5.0,骨转移灶SUVmax 11.8);随后CT引导活检及免疫组化证实:肺病灶PD-L1低表达,骨转移灶PD-L1高表达;(B)24例患者病灶68Ga-NK224摄取(SUVmax)全景展示:包含24个原发灶和215个转移灶,图示呈现SUVmax值、肿瘤大小、活检部位等多维度参数上的差异。
连续68Ga-NK224 PET/CT监测PD-L1靶点可及性,指导PD-L1免疫治疗给药频率
为评估抗PD-L1抗体对肿瘤PD-L1靶点的结合情况,本研究对接受PD-L1免疫治疗的NSCLC患者进行了连续的68Ga-NK224 PET/CT扫描,时间节点包括治疗前基线及治疗后1、7、21天。如图6所示,基线期NSCLC原发灶的68Ga-NK224摄取显著,表明肿瘤对该显像剂的亲和力较强。经过抗PD-L1免疫治疗后,患者在治疗后1天和7天的肿瘤68Ga-NK224摄取明显降低,提示治疗初期药物对PD-L1靶点的有效结合与抑制作用。然而,在治疗后21天时,病灶对68Ga-NK224的摄取出现轻度升高,这表明抗PD-L1抗体在超过21天的时间内仍能有效占据PD-L1靶点。此外,研究还发现,接受抗PD-L1免疫治疗后,肝脏、脾脏和骨髓的68Ga-NK224摄取显著降低,而正常肺组织的显像剂摄取变化较小。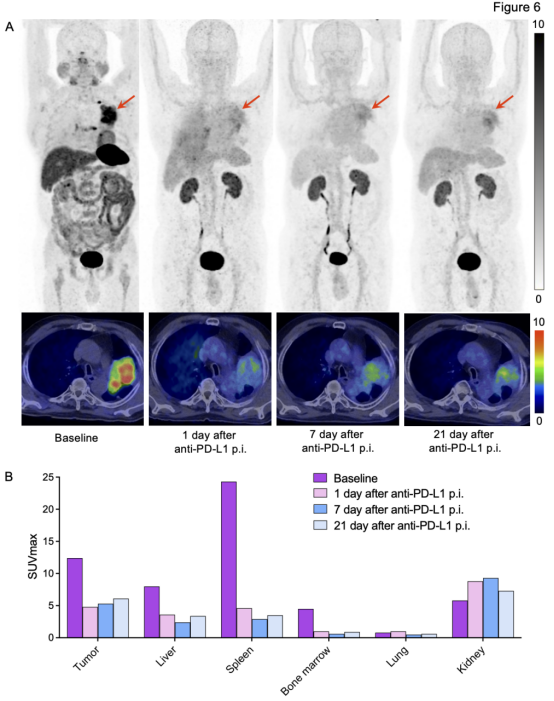
图6. PD-L1抗体治疗前后连续68Ga-NK224 PET/CT扫描评估。(A)NSCLC患者治疗前和PD-L1抗体给药后第1、7和21天的68Ga-NK224 PET/CT图像;(B)柱状图描绘了PD-L1抗体治疗前后肿瘤、肝脏、脾脏、骨髓、肺和肾脏等主要器官的SUVmax变化。
最后,研究团队探讨了连续68Ga-NK224 PET显像动态监测免疫治疗期间PD-L1的靶点状态,进而评估肿瘤病灶中PD-L1抗体对相应靶点的占用情况,从而为PD-L1免疫治疗的频率提供指导(见图7A-B)。在U87-MG移植瘤小鼠模型中,基线期肿瘤对68Ga-NK224表现出高度摄取(见图7C)。在接受PD-L1抗体(10 mg/kg)治疗后的第1和第3天,肿瘤摄取持续下降,而在治疗后的第5和第7天,肿瘤摄取略有回升(第3天为0.6±0.2% ID/g,第7天为1.7±0.2% ID/g,见图7D),这证实了PD-L1抗体在肿瘤病灶中至少持续了7天的靶点占用。
为了探索PD-L1分子影像引导的靶点监测在免疫治疗优化中的价值,研究团队比较了两种给药方案:一种是基于68Ga-NK224 PET指导的每周一次给药方案,另一种是传统的每周三次给药方案。在hu-CD34+人源化免疫系统小鼠的U87-MG异种移植瘤模型中,对照组肿瘤快速进展,而两种hPD-L1抗体方案均有效抑制了肿瘤生长。值得注意的是,68Ga-NK224 PET指导下的低频给药组的疗效并未逊色于传统治疗方案(见图7E-F)。这表明,连续的68Ga-NK224 PET可在免疫治疗期间动态监测病灶中的PD-L1表达,有望作为指导PD-L1抗体治疗频率和剂量调整的精准工具,具有实现个体化治疗策略优化的潜力。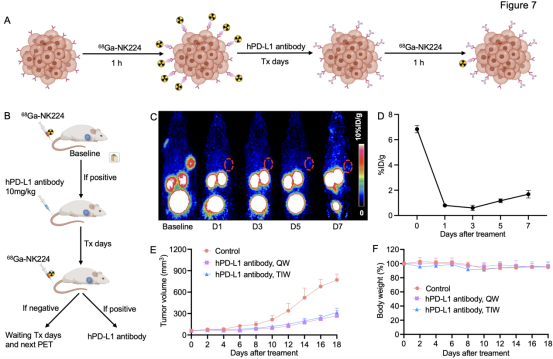
图7. 利用68Ga-NK224 PET动态监测hPD-L1靶点占用率,指导hPD-L1抗体给药频率。(A)使用hPD-L1抗体治疗前后,68Ga-NK224 PET显像评估可利用的PD-L1靶点的示意图;(B)实验设计说明了68Ga-NK224 PET对hPD-L1靶点变化的动态可视化,为优化给药间隔提供了见解;(C-D)PET成像结果和定量分析68Ga-NK224在基线和hPD-L1抗体给药后第1,3,5和7天的肿瘤摄取。红色圆圈表示肿瘤区域。(E-F)给药频率为每周1次(QW)组、常规频率为每周3次(TIW)组和生理盐水对照组肿瘤生长曲线和体重变化的比较。
结论
基于NK224的新型PD-L1靶向多肽,兼具优良的肿瘤靶本底比及体内分布性质,能够准确评估全身肿瘤病灶中PD-L1的表达水平,并能清晰可视化其PD-L1空间异质性。此外,该探针还能动态监测免疫治疗期间病灶中的PD-L1靶点状态,为免疫治疗的个体化给药频率优化提供了全新的影像学工具与策略支持。这一研究为肿瘤免疫治疗的精准化发展开辟了新的方向。
原文链接:https://doi.org/10.1158/1078-0432.CCR-25-0160
通讯作者简介

陈皓鋆,厦门大学附属第一医院核医学科&闽南PET中心副主任,科研处副主任,临床医学研究院副院长。教授,博士生导师,国家优秀青年科学基金获得者。研究方向为核医学显像及治疗的临床转化。担任核医学顶刊J Nucl Med编委、 Eur J Nucl Med Mol Imaging编委、《中华核医学与分子影像杂志》编委;主持国家自然科学基金3项,并主持福建省杰出青年科学基金、福建省卫健委重大项目。入选中国研究型医院评价遴选“研究型人才”、福建省卫健委“高层次领军人才”;荣获中华医学会核医学分会“希望之星”、北美核医学与分子影像学会“青年科学家”奖(SNMMI Ones to Watch,全球30名)。

林勤,主任医师,厦门大学教授,博士生导师,厦门大学附属第一医院党委副书记。现任中华医学会放射肿瘤治疗学分会委员,福建省医学会放射肿瘤治疗学分会副主任委员,福建省抗癌协会鼻咽癌专业委员会副主任委员,厦门市医学会肿瘤放疗分会主任委员。任《中华放射医学与防护杂志》等多种期刊编委。美国得克萨斯大学M.D. Anderson 癌症中心访问学者,美国Duke University访问学者。主持或已主持国家自然科学基金、福建省卫生厅、厦门市科技局及全国多中心前瞻性临床研究厦门分中心等多项课题。研究内容多次在美国国际放射肿瘤学年会上壁报交流。近五年以通讯作者在Clin Cancer Res、J Nucl Med、Signal Transduction and Targeted Therapy、 Eur J Nucl Med Mol Imaging、Radiotherapy & Oncology、Theranostics、中华核医学与分子影像杂志等期刊发表研究论著20余篇。主要研究方向:分子影像引导下的鼻咽癌、肺癌、肝癌等领域的肿瘤精确放疗以及SBRT(立体定向低分割放射治疗)。

钟山,病理科副主任(主持工作),主任医师。从事病理诊断工作20多年。擅长肿瘤病理诊断,精于术中冰冻、免疫组化及分子病理诊断。有丰富的临床教学经验,系国家级住院医师规范化培训基地主任。发表多篇学术论文,参编多项行业指南。兼任中华医学会病理分会学组委员、厦门市病理质控中心主任委员、厦门市医学会病理学分会主任委员。
第一作者简介

赵亮,厦门大学附属第一医院核医学科&闽南PET中心主治医师。以第一/通讯作者在J Clin Invest、Clin Cancer Res(2篇)、Radiology、J Nucl Med(6篇)、Eur J Nucl Med Mol Imaging(7篇)、Signal Transduction and Targeted Therapy、Theranostics、JITC等国际权威期刊发表论著31篇(5篇入选ESI高被引论文)、个案报道8篇,H影响因子25,累计被引超过2600次。连续入选2022、2023全球“前2%顶尖科学家”榜单(world’s top 2% scientists),获得2023、2024、2025年北美核医学与分子影像学会Alavi-Mandell奖,2024年北美核医学与分子影像年会国际最佳摘要和旅行奖,并以主要完成人获厦门市科技进步二等奖、福建省科技进步三等奖、福建省抗癌协会科技进步奖二等奖。

逄一臻,厦门大学2021级肿瘤学博士研究生,导师为厦门大学附属第一医院林勤教授和陈皓鋆教授,硕博在读期间以第一作者/共同第一作者在J Clin Invest、Clin Cancer Res、Radiology、J Nucl Med、Eur J Nucl Med Mol Imaging、Signal Transduction and Targeted Therapy、JITC等国际权威期刊发表研究论文多篇。多次硕士及博士研究生国家奖学金,获得2021欧洲核医学会(EANM)“年度最佳论文奖”、2024年北美核医学协会Alavi-Mandell奖,以共同完成人身份获厦门市科技进步二等奖、福建省抗癌协会科技进步奖二等奖。

丁毅,副主任医师,毕业于福建医科大学病理学专业,从事病理诊断近20年,曾于北京友谊医院病理科进行淋巴造血系统亚专科进修,师从国内著名淋巴瘤专家周小鸽教授。福建省医学会消化病学分会消化病理学组委员,福建省医师协会病理科医师分会胸肺疾病专业委员会委员,福建省海峡肿瘤防治科技交流协会甲状腺肿瘤分会委员,厦门市医师协会病理医师分会第一届委员会委员,厦门医师协会肿瘤青委胃肠学组成员。淋巴造血系统、泌尿系统、消化系统肿瘤等及炎症性肠病病理诊断。