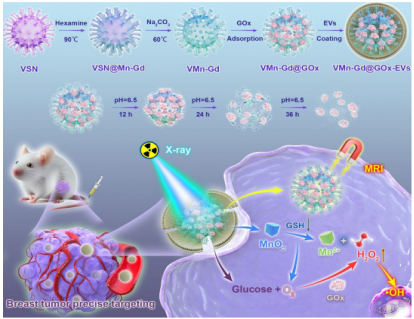
近期,厦门大学附属第一医院乳腺外科苏永辉博士联合西南医科大学附属医院团队,在生物学TOP期刊《Journal of Nanobiotechnology》(中科院一区,IF:12.6),发表了题为“Tumor-microenvironment triggered Mn-Gd based nanosystem for breast carcinoma suppression via synergistic radiotherapy and glutathione-depleting along with glucose oxidase combination enhanced ROS storm”的重要研究成果。该研究开发了一种病毒仿生结构的Mn-Gd双金属纳米平台(VMn-Gd@GOx-EVs),通过肿瘤微环境响应性释放金属离子、消耗谷胱甘肽(GSH)、生成过氧化氢(H2O2)并缓解肿瘤缺氧,实现了放疗(RT)与氧化疗法(OXT)的高效协同,显著增强了对乳腺癌的抑制效果。

一、研究背景介绍
乳腺癌是全球女性中最常见的恶性肿瘤,放疗是其重要的治疗手段之一。然而,肿瘤微环境(TME)中的缺氧、高浓度GSH和高葡萄糖代谢等特点常导致放疗抵抗,限制其疗效。近年来,功能性纳米材料作为放射增敏剂受到广泛关注。钆(Gd)基纳米材料因其优异的X射线衰减能力被用于增强放疗,但其生物降解性和肿瘤穿透性较差。
病毒仿生纳米颗粒具有良好的穿透性、生物识别能力和免疫激活潜力。本研究团队前期开发了一种具有粗糙表面的中空介孔Mn-Gd基纳米球,模拟病毒结构,增强细胞膜结合和药物递送效率。为进一步克服TME的限制,本研究引入葡萄糖氧化酶(GOx)和细胞外囊泡(EVs)涂层,构建了多功能纳米平台VMn-Gd@GOx-EVs,实现肿瘤靶向、微环境响应、GSH消耗、O₂生成和ROS风暴诱导的协同治疗。
二、纳米平台设计与构建
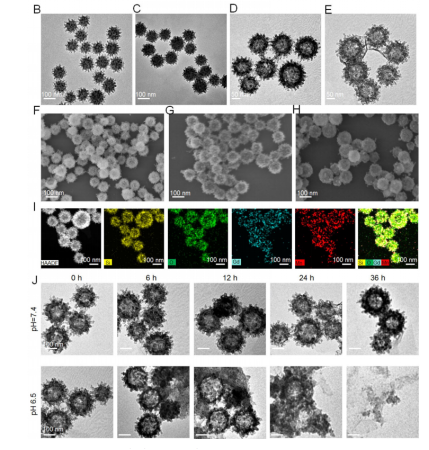
VMn-Gd@GOx-EVs的制备采用硬模板法(图1A)。首先合成病毒样介孔二氧化硅模板(VSN),在其表面通过水热法形成MnO2-Gd2O3杂化壳(VSN@Mn-Gd),随后去除模板得到中空病毒样Mn-Gd纳米颗粒(VMn-Gd)。GOx通过物理吸附负载于VMn-Gd表面,最后通过电穿孔法将EVs膜包裹于纳米颗粒外部,形成VMn-Gd@GOx-EVs。

TEM和SEM图像显示,VMn-Gd保留了病毒样的刺突结构(图1B–H),元素映射证实Si、O、Mn、Gd均匀分布(图1I)。在酸性条件(pH 6.5)下,纳米颗粒表现出时间依赖性降解,36小时后完全崩解释放约10 nm的小颗粒,显著增强肿瘤穿透能力(图1J)。GOx在pH 6.5下的释放效率是pH 7.4的7倍以上,表明其良好的肿瘤微环境响应性。
三、MRI性能与体外ROS生成能力
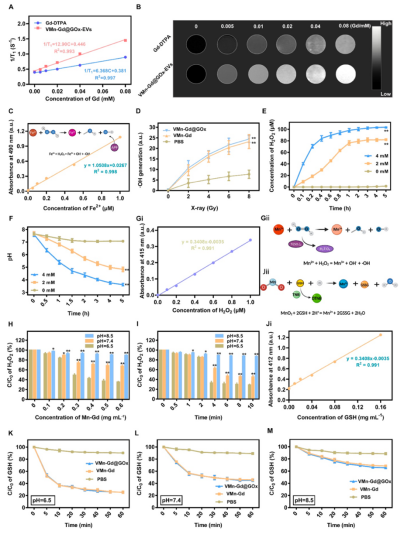
由于Mn和Gd离子在酸性TME中释放,VMn-Gd@GOx-EVs表现出优异的T₁加权MRI对比效果,r₁弛豫率为12.90 mM⁻¹s⁻¹,是临床常用对比剂Gd-DTPA的2倍(图2A–B)。使用APF探针检测·OH生成,发现VMn-Gd@GOx在X射线照射下(8 Gy)产生的•OH显著高于对照组,且具有剂量依赖性(图2C–D)。
GOx在葡萄糖存在下快速生成H2O2并降低pH(图2E–F),促进VMn-Gd降解和Mn²⁺介导的类芬顿反应。在弱酸性条件下(pH 6.5),H2O2分解效率是pH 8.5的2.5倍(图2H–I)。DTNB检测显示,VMn-Gd@GOx在pH 6.5下10分钟内即可显著消耗GSH(图2K–M),为ROS风暴创造有利条件。
四、体外细胞杀伤机制研究
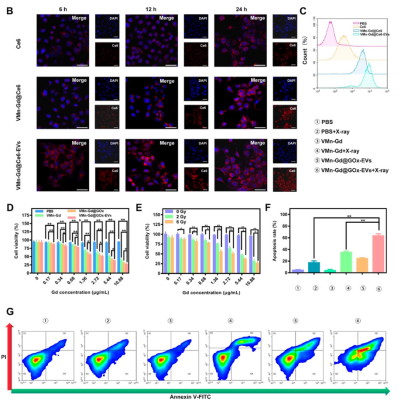
4T1乳腺癌细胞对VMn-Gd@Ce6-EVs的内吞效率显著高于游离Ce6和未包EVs的纳米颗粒(图3B-C),表明EVs涂层增强细胞摄取和靶向性。CCK-8实验显示,VMn-Gd@GOx-EVs联合X射线(6 Gy)照射后细胞存活率仅为26.12%,凋亡率高达61.20%(图3D–G)。
GOx催化葡萄糖消耗导致缺氧,诱导HIF-1α表达上调;而Mn²⁺介导的O₂生成和GSH消耗则缓解缺氧并增强放疗敏感性(图4A-B, G)。γ-H2AX荧光和Western blot分析证实VMn-Gd@GOx-EVs + X射线组DNA损伤最显著(图4C–D, G–J)。克隆形成实验显示该组克隆形成率仅为7.73%,显著低于其他组(图4E–F)。
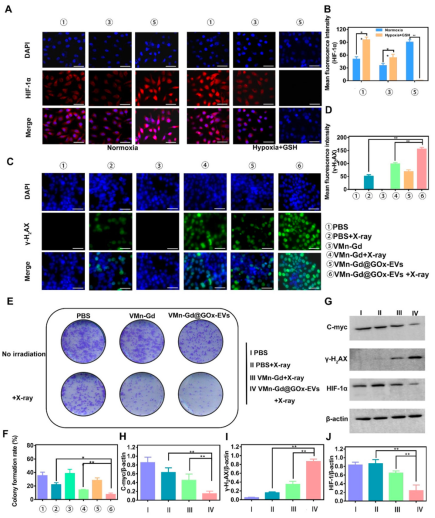
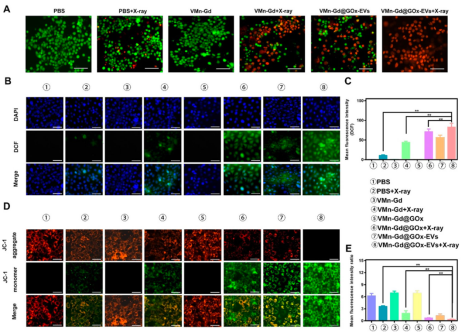
JC-1和DCFH-DA染色进一步证实,VMn-Gd@GOx-EVs + X射线处理导致线粒体膜电位下降和ROS水平显著升高(图5),协同诱导肿瘤细胞死亡。
五、体内靶向与治疗效果
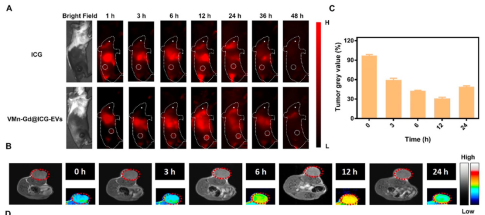
在小鼠4T1乳腺癌模型中,VMn-Gd@ICG-EVs注射后12小时肿瘤部位NIR荧光和MRI信号达到峰值(图6A-C),表明良好的肿瘤靶向和富集能力。
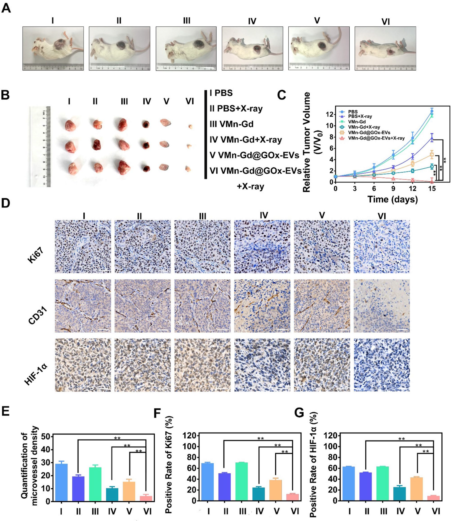
X射线照射12小时后进行放疗,VMn-Gd@GOx-EVs + X射线组肿瘤生长抑制效果最佳,肿瘤体积最小(图7A-C)。免疫组化显示该组Ki67、CD31和HIF-1α表达显著降低(图7D-G),表明增殖抑制、血管破坏和缺氧缓解。
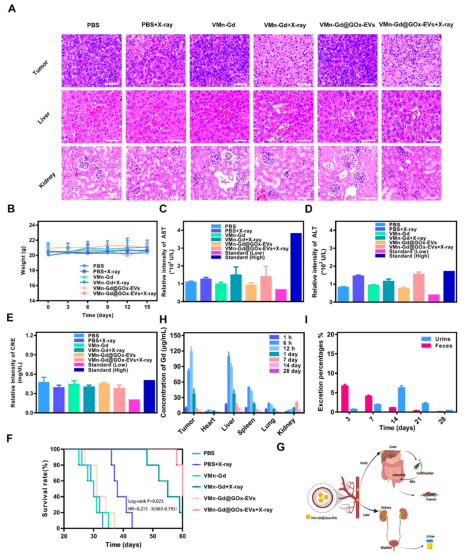
六、生物安全性评价
小鼠体重、血清生化指标(AST、ALT、CRE)和血细胞计数均在正常范围内,主要器官未见明显病理损伤(图8A-E)。生存分析显示,VMn-Gd@GOx-EVs + X射线组小鼠生存期超过60天,显著优于其他组(图8F)。纳米颗粒主要通过肝脾代谢,最终通过粪便和尿液排出(图8G-I),且EVs包覆有效避免免疫识别和细胞因子风暴。
七、总结
本研究成功构建了一种多功能、TME响应的病毒仿生纳米平台VMn-Gd@GOx-EVs,通过EVs靶向、TME响应的离子释放、GOx介导的葡萄糖消耗与H2O2生成、Mn²⁺催化的类芬顿反应以及通过协同放疗、氧化治疗和免疫调节,显著抑制了乳腺癌生长,实现了高效的ROS风暴诱导和肿瘤协同治疗,并具备良好的成像能力和生物安全性,展现出广阔的临床转化前景。
原文链接:https://doi.org/10.1186/s12951-025-03636-z

苏永辉,厦门大学附属第一医院乳腺外科,主治医师,医学博士。毕业于复旦大学上海医学院,师从国内著名乳腺外科专家吴炅教授。福建省及厦门市高层次人才(C类)。现任福建省海医会乳腺肿瘤微无创分会青委会委员,福建省海峡肿瘤防治交流协会乳腺肿瘤防治分会青委会委员,厦门市医学会乳腺病学分会委员,厦门市抗癌协会乳腺癌专业委员会委员。主持国家自然科学基金项目一项,福建省自然科学基金项目一项。以第一作者/通讯作者在Journal of Nanobiotechnology、Materials Today Bio、Journal of Translational Medicine、npj Breast Cancer、The Breast、CANCER、The Oncologist等国际权威期刊发表多篇论著。