近日,《欧洲核医学与分子影像杂志》(Eur J Nucl Med Mol Imaging,Q1区,2021 IF=10.057)刊登了来自厦门大学附属第一医院核医学科及肿瘤放疗科团队关于“68Ga-FAPI PET/CT预测食管癌根治性放化疗预后”的临床研究。改研究通过PET/CT分子影像的方法为食管癌患者放化疗的预后预测提供了新方法。论文通讯作者为核医学科陈皓鋆教授,放疗科林勤教授。

【研究背景】
食管鳞状细胞癌 (ESCC) 是东亚地区食管癌的主要组织学亚型,而食管腺癌更常见于西欧和北美地区。中国患者的人数占全球 ESCC 患者的一半以上。目前,食管癌根治性切除术是非转移性ESCC的主要治疗手段。然而,50%以上的ESCC患者就诊时已是晚期,失去了手术机会。对于不可切除和局部晚期的ESCC患者,其治疗主要依靠放射治疗或放化疗联合的综合治疗,但总体预后不良。针对这类患者,准确判断预后或总生存率的指标是非常必要的,这将有利于及时优化治疗策略,提高生存率。
诸多研究显示临床肿瘤分期(T分期)和区域淋巴结分期(N分期)可以预测各类非转移性癌症的临床预后。然而,仅仅通过临床分期的结果可能并不足以预测 ESCC 患者的预后。另有研究报告表明,通过常规影像学技术监测肿瘤治疗前后形态大小的变化,可以早期评估ESCC 患者的治疗响应,预测预后。例如,CT和磁共振成像(MRI)的图像参数和纹理特征与接受放化疗的患者的预后具有统计学显著相关性。[18F]FDG PET/CT是一种广泛用于肿瘤检测、分期和治疗反应评估的分子影像技术。在过去的十年里,大量研究报告了[18F]FDG PET/CT代谢参数与多种恶性肿瘤临床预后之间的关系,在监测治疗疗效、制定个体化治疗方案中发挥重要的作用。
随着分子影像技术的不断发展与成熟,新近研究报告了一种靶向成纤维细胞活化蛋白 (FAP) 的新型放射性分子影像探针(FAPI)可应用于对多种实体瘤的PET/CT显像。也有相关个案报告了FAPI PET/CT 对于ESCC 转移淋巴结及骨/内脏远处转移灶的检出方面显著优于 [18F] FDG PET/CT。此外,我们及其他课题组的前期研究证明[68Ga]Ga-FAPI PET/CT 可为食管癌放射治疗的靶区勾画方案提供补充信息。然而,尚无[68Ga]Ga-FAPI PET/CT 预测恶行肿瘤预后价值的研究报告。在本研究中,我们旨在分析[68Ga]Ga-FAPI PET/CT可否预测食管鳞癌根治性放化疗的预后,为食管癌患者的预后评估提供依据。
【研究方法】
回顾性分析本院2019-2020年期间接受根治性放化疗且随访资料完整的ESCC患者37例。根据实体瘤疗效评估标准 (RECIST) 1.1 版评估临床预后(无进展生存期 [PFS]和总生存期 [OS])。本研究中位随访时间为 24 个月(范围,16-29个月)。随访过程中有19 例ESCC患者出现疾病进展,其中18例死于食管癌。
原发灶GTV测量方法:在原发灶放射性浓聚区域范围内以40%SUVmax为阈值,工作站软件自动勾画感兴趣区(Region of interest,ROI),并根据横断面、矢状面、冠状面3个层面的图像进行手工调节,尽量准确地使各层面原发灶均包含在ROI内,软件自动计算得出GTVFAPI,单位为cm³。TL-FAPI = GTV x SUVmean。
采用IBM SPSS 22.0软件进行统计分析。计量资料正态分布通过K-S检验(以均数±标准差)表示。连续变量如SUVmax、GTV、TL-FAPI转换为二分类变量进行统计分析,利用ROC曲线寻找SUVmax、GTV、TL-FAPI的最佳界值将其分为高值组及低值组。生存分析采用Kaplan-Meier法进行单因素分析,组间生存曲线比较采用Log-rank检验,P<0.05差异有统计学意义。
【研究结果】
1. 不同TNM期间FAPI-PET的参数比较
FAPI-PET参数(SUVmax-FAPI: 最大标准摄取值; GTVFAPI: FAPI阳性肿瘤的大体体积; TL-FAPI: FAPI阳性总累积病灶,TL-FAPI = SUVmean × GTVFAPI)的定量分析结果显示,不同T分期患者间的FAPI-PET参数具有显著统计学差异(图1)。例如,T4期患者的多个FAPI-PET 参数显著高于T2/T3期患者:SUVmax-FAPI (17.6 ± 5.7 vs. 13.3 ± 4.9, P = 0.009)、GTVFAPI (46.0 ± 34.7 cm3 vs. 14.7 ± 10.1 cm3,P < 0.001)和 TL-FAPI(444.2 ± 315.7 g vs. 118.7 ± 92.1 g,P < 0.001)。然而,不同N分期患者间的PET参数无统计学差异。
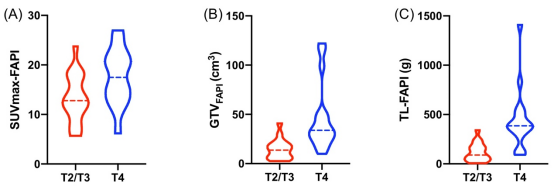
图 1. T2/T3肿瘤与T4肿瘤间SUVmax-FAPI (A)、GTVFAPI (B)和TL-FAPI (C) 的差异。
2. FAPI-PET参数与临床预后之间的相关性分析
通过ROC曲线计算GTVFAPI和TL-FAPI 预测 PFS 的最佳cut-off值。GTVFAPI 和 TL-FAPI的最佳cut-off值分别为33.9 cm3(ROC 曲线下面积 [AUC] = 0.737;P = 0.019)和226.7g(AUC = 0.726;P = 0.025)(图 2A-B)。随后通过ROC曲线计算GTVFAPI和TL-FAPI预测OS的最佳cut-off值,其最佳cut-off值与预测PFS值的cut-off值相同。GTVFAPI和TL-FAPI 的 AUC 值均 > 0.75(图 2C-D)。然而,根据SUVmax计算出的最佳cut-off值与PFS(SUVmax = 13.4;AUC = 0.609;P = 0.282)或OS(SUVmax = 18.2;AUC = 0.630;P = 0.196)均无统计学关联。
GTVFAPI ≤ 33.9 cm3 的ESCC患者较 GTVFAPI > 33.9 cm3 患者具有更好的 PFS(图 3A,P = 0.005)。同样,以最佳TL-FAPI的cut-off值(226.7g)为界,两组患者间的PFS存在统计学差异(P < 0.001,图 3B)。图 3C-D显示了GTVFAPI和TL-FAPI在OS预测中的Kaplan-Meier生存曲线。这些PET参数与患者的OS呈负相关。例如, GTVFAPI高值组(>33.9 cm3 , n=9)的1年生存率显著高于GTVFAPI低值组(GTV≤33.9 cm3,n=25),两组的OS生存曲线具有统计学差异(80% vs. 22%,P < 0.001)。具有代表性的baseline PET/CT和治疗后follow-up CT图像如图4所示。
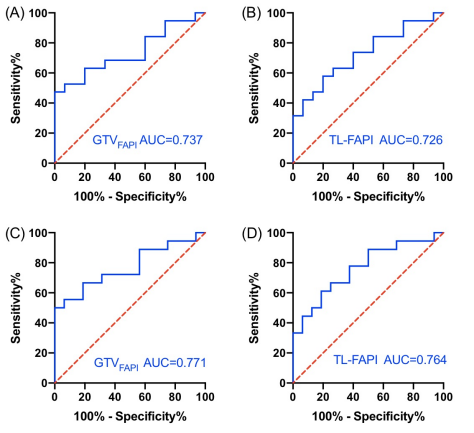
图 2. 与无进展生存期(PFS)相关GTVFAPI (A) 和TL-FAPI (B)最佳界值的ROC曲线。 与总生存期(OS)相关GTVFAPI (C) 和 TL-FAPI (D) 最佳界值的ROC曲线。
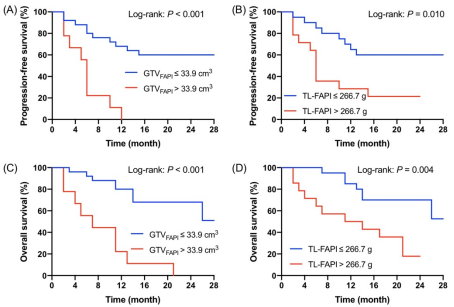
图 3. 根据GTVFAPI (A) 和 TL-FAPI (B) 分组的无进展生存期(PFS)的 Kaplan-Meier 曲线。 根据GTVFAPI (C) 和 TL-FAPI (D) 分组的总生存期(OS)的Kaplan-Meier 曲线。
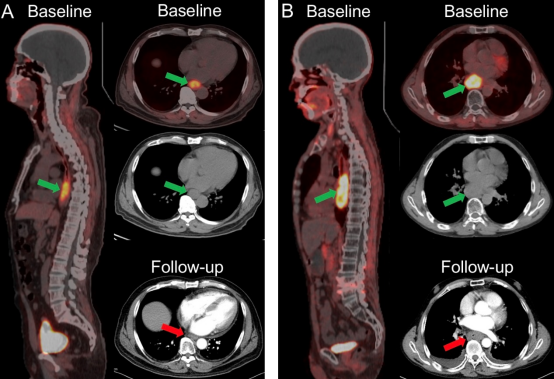
图 4. (A) 男,62 岁,ESCC初诊患者,接受PET/CT进行肿瘤分期。 [68Ga]Ga-FAPI PET/CT (GTVFAPI) 计算基线GTV为17.1 cm3 (<33.9 cm3)。随访增强 CT(治疗后1个月)判定为部分缓解(PR)。该患者的总生存期为29个月(生存,随访中)。(B) 男,52 岁,ESCC初诊患者,接受PET/CT进行肿瘤分期。基线GTV-FAPI为43.3 cm3 (>33.9 cm3)。随访增强CT判定为疾病稳定(SD)。该患者的总生存期为11个月。
3. 食管癌的单变量和多变量分析
单变量分析显示,PFS 与 T 分期、N 分期、GTVFAPI 和 TL-FAPI 相关,而 OS 与 T分 期、GTVFAPI 和 TL-FAPI 相关,但与 N 分期无关(表 1)。在多变量分析中,只有 GTVFAPI 是 PFS(HR,5.76;95% CI,2.13-15.57,P = 0.001)和 OS(HR,4.96;95% CI,2.55–18.79, P = 0.001)的独立预后因素。
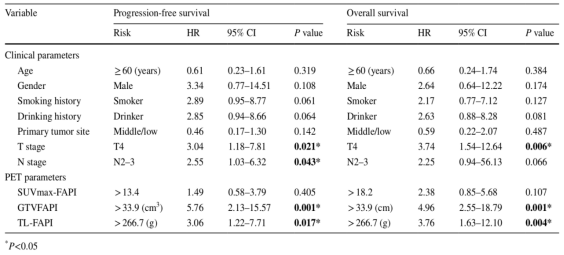
表1. 用于预测无进展生存期和总生存期 Cox 回归模型的单变量分析
结论: 对于不可切除的晚期食管癌患者来说,治疗前基线[68Ga]Ga-FAPI PET/CT原发灶GTVFAPI、TL-FAPI对判断其接受根治性放化疗的预后具有一定预测价值。高GTVFAPI、高TL-FAPI的患者预后较差,GTVFAPI可用作接受根治性放化疗ESCC 患者临床PFS和OS的独立预后因素。因此,治疗前可根据这些参数对患者进行危险分层,从而制定个体化治疗方案来改善预后。未来尚需更大样本和更长观察期的进一步研究。
原文地址:https://doi.org/10.1007/s00259-022-05989-1
作者风采
通讯作者 陈皓鋆

陈皓鋆,厦门大学附属第一医院核医学科及闽南PET中心副主任医师,现任中国医师协会核医学分会青年委员,中华医学会核医学分会淋巴瘤PET/CT工作委员会委员。荣获福建省杰出青年基金资助、全国青年岗位能手、福建省卫生健康中青年领军人才、厦门市青年双百人才、中华医学会核医学分会“希望之星”奖;曾获北美核医学会(SNMMI)最受瞩目“青年科学家奖”(Ones to Watch, 全球30名)、SNMMI“临床研究奖”第1名;欧洲核医学会(EANM)“年度最佳论文奖”,亚洲分子影像学会(FASMI)“青年科学家”奖等多项国际重要奖项。主持国家自然科学基金项目2项、福建省中青年重大项目1项;近5年以第一/通讯作者在医学影像领域顶刊Radiology、J Nucl Med、Eur J Nucl Med Mol Imaging发表研究论文25余篇,以第一完成人获厦门市科技进步奖1项。
通讯作者 林勤

林勤,主任医师,厦门大学教授,博士生导师,厦门大学附属第一医院党委副书记。现任中华医学会放射肿瘤治疗学分会委员,福建省医学会放射肿瘤治疗学分会副主任委员,福建省抗癌协会鼻咽癌专业委员会副主任委员,厦门市医学会肿瘤放疗分会主任委员。任《中华放射医学与防护杂志》等多种期刊编委。美国得克萨斯大学M.D. Anderson 癌症中心访问学者,美国Duke University访问学者。主持或已主持国家自然科学基金、福建省卫生厅、厦门市科技局及全国多中心前瞻性临床研究厦门分中心等多项课题。研究内容多次在美国国际放射肿瘤学年会上壁报交流。近五年以通讯作者在Eur J Nucl Med Mol Imaging、Radiotherapy & Oncology、Theranostics、中华核医学与分子影像杂志等期刊发表研究论著20余篇。主要研究方向:分子影像引导下的鼻咽癌、肺癌、肝癌等领域的肿瘤精确放疗以及SBRT(立体定向低分割放射治疗)。
第一作者 赵亮

赵亮,厦门大学附属第一医院肿瘤学博士研究生在读,导师林勤教授和陈皓鋆副主任医师,研究方向为分子影像引导下肿瘤诊疗一体化,第一作者(含共一)发表SCI论著15篇,中文核心论文1篇。曾获国家奖学金、厦门大学本栋奖学金和唐立新奖学金。
共同一作 逄一臻

厦门大学2021级博士研究生,中共党员,曾获厦门大学医学院“优秀团员”,厦门大学“三好学生”、厦门大学“优秀毕业生”、厦门大学医学院“远思奖学金”、厦门大学“鹭燕奖学金”、厦门大学校庆奖学金“本栋奖学金”、研究生“国家奖学金”等荣誉。以第一或共同第一作者在Radiology、Eur J Nucl Med Mol Imaging、Clin Nucl Med等国际一流期刊发表多篇SCI期刊论文。
共同一作 陈珊宇

陈珊宇,厦门大学附属第一医院肿瘤放射治疗科副主任医师,毕业于华中科技大学同济医学院,2011年中山大学肿瘤防治中心进修肿瘤放疗专业。毕业后至今一直从事肿瘤放射治疗专业。现任中国医师协会放射肿瘤治疗医师分会食管癌放疗组委员;福建省抗癌协会放射肿瘤专业委员会营养组委员;福建省抗癌协会第一届肿瘤科普专业委员会委员;福建省医学会放射肿瘤治疗学分会第二届委员会青年委员会委员;福建省医学会放射治疗学分会胸部放射治疗学委员。能娴熟处理头颈部,胸部,腹部等各种恶性肿瘤。已在专业期刊发表多篇专业论著。