我院陈皓鋆团队近期发表于《Journal of Nuclear Medicine》(IF=11.1,JCR Q1)的基础研究,题目为“Development of FAPI Tetramers to Improve Tumor Uptake and Efficacy of FAPI Radioligand Therapy”(DOI: https://doi.org/10.2967/jnumed.123.265599)。在这篇文章中,作者构建了一种靶向FAP的新型四聚体放射性探针DOTA-4P(FAPI)4,并评价其在FAP表达阳性荷瘤鼠模型中的生物分布,68Ga/64Cu PET显像,及177Lu放射靶向治疗效果。实验结果显示,在多结合位点效应的作用下,FAPI的四聚体与FAP具有更高的结合能力,有望将来应用于FAP阳性表达实体瘤的放射靶向治疗。
本文的通讯作者为厦门大学附属第一医院核医学科及闽南PET中心的陈皓鋆教授,厦门大学郭志德教授。厦门大学附属第一医院博士生逄一臻、赵亮,厦门大学公共卫生学院博士生方建阳为本文共同第一作者。
原文链接:https://jnm.snmjournals.org/content/early/2023/06/15/jnumed.123.265599
研究背景介绍
肿瘤相关成纤维细胞(CAF)是多种上皮性肿瘤间质的重要组成部分,在肿瘤生长、免疫抑制和肿瘤侵袭中发挥重要作用。成纤维细胞激活蛋白(fibroblast activation protein,FAP)为Ⅱ型跨膜丝氨酸蛋白酶,其高表达于多种上皮性肿瘤相关成纤维细胞中,而在正常组织、良性肿瘤间质中无表达或表达较低。因此,以FAP为靶点的分子探针(FAP抑制剂,FAPI)是一种有前景新型成像和治疗技术,可应用于多种恶性肿瘤的PET显像及靶向治疗中。
一些基于喹啉的FAP抑制剂(FAPI)已经被开发进行PET显像和靶向治疗。68Ga-FAPI-46似乎是该系列中最有希望的衍生物,具有较高的肿瘤/本底比和较高的肿瘤摄取。然而,其相对较短的肿瘤滞留时间可能限制了其在恶性肿瘤靶向治疗中的应用。
研究设计思路
在笔者团队的前期研究中,利用多价效应和添加两亲性聚乙二醇连接体(PEG修饰)的方法成功设计并合成了一种新型的FAPI二聚体(DOTA-2P(FAPI)2)。临床前和临床PET研究表明,68Ga-DOTA-2P(FAPI)2比68Ga-FAPI-46具有更高的肿瘤摄取和更长的肿瘤滞留时间。其他FAPI二聚体,包括DOTAGA、(SA.FAPi)2和BiOncoFAP也获得了类似的结果。因此,多价效应可能是开发FAP靶向放射性药物的有效策略。此外,如果能进一步提高肿瘤滞留时间和摄取,靶向FAP的放射配体治疗可能更有效。
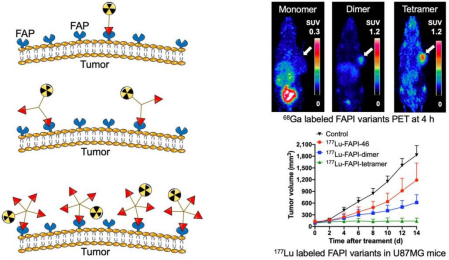
在这篇文章中,作者团队基于FAPI-46基础构建FAPI四聚体,在4个FAPI活性基团之间各加入4个微型聚乙二醇(polyethylene glycol, PEG)(PEG3)间隔,以DOTA作为螯合剂用于放射性核素68Ga和177Lu的标记(前体表示为DOTA-4P(FAPI)4)并用于PET显像及放射性配体治疗实验;以NOTA作为螯合剂用于放射性核素64Cu的标记(前体表示为NOTA-4P(FAPI)4)并用于PET显像(图1)。本研究旨在探讨FAPI四聚体在体外和体内的肿瘤靶向潜力,并评估这种形式是否比其单体和二聚体类似物更有效。

图1. FAPI四聚体DOTA-4P(FAPI)4的化学结构
实验结果介绍
作者团队成功合成FAPI四聚体并进行放射性标记。68Ga-DOTA-4P(FAPI)4和177Lu-DOTA-4P(FAPI)4标记产率均>90%,放化纯均大于95%;68Ga与177Lu标记的四聚体与血清常温下共温育4小时及24小时后未观察到显著的脱金属和游离放射性,表明其具有高度稳定性。利用HT-1080-FAP细胞进行FAPI-46、DOTA-2P(FAPI)2和DOTA-4P(FAPI)4的细胞摄取阻断实验和细胞竞争结合实验。细胞摄取阻断实验提示68Ga-DOTA-4P(FAPI)4的摄取值显著高于68Ga-DOTA-2P(FAPI)2和68Ga-FAPI-46 (120 min时57.98±0.27% vs. 32.40±5.36% vs. 22.93±0.33%);加入FAPI-46前体后可以显著阻断68Ga-DOTA-4P(FAPI)4和FAP之间的结合,证实了FAPI四聚体靶向FAP的特异性(图2)。细胞竞争结合实验中,通过加入不同浓度FAPI-46前体,拟合得到68Ga-FAPI-46、68Ga-DOTA-2P(FAPI)2和68Ga-DOTA-4P(FAPI)4的IC50值分别为11.38 nM、17.04nM和15.56nM(图2)。三者的IC50相当,表明FAPI结构的四聚体在体外对受体亲和力影响较小。
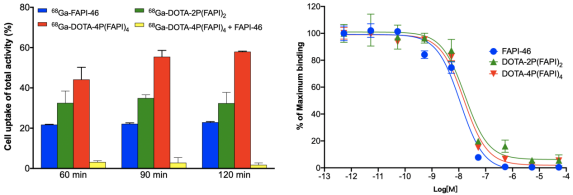
图2. 68Ga标记FAPI单体、二聚体和四聚体体外细胞结合实验
在证明四聚体探针在HT-1080-FAP细胞中具有更高的肿瘤摄取后,为进一步评价68Ga-DOTA-4P(FAPI)4的体内药代动力学特征,对HT-1080-FAP荷瘤鼠模型进行60 min动态PET扫描(图3)。如图3A所示,68Ga-DOTA-4P(FAPI)4在肿瘤中的摄取非常迅速,呈持续上升趋势;而68Ga-DOTA-4P(FAPI)4在心脏、肾脏和肝脏中的摄取随时间逐渐降低。在对HT-1080-FAP荷瘤鼠模型进行不同时间点静态PET扫描中,PET显像结果示68Ga-DOTA-4P(FAPI)4和68Ga-DOTA-2P(FAPI)2在肿瘤中一直保持较高的显像剂浓聚,正常脏器中摄取较低,图像具有良好的靶/本底比(图3B-C)。在与相同剂量和比活度的68Ga-FAPI-46对比实验中,3种探针的体内分布特征相似(图3D)。PET半定量结果示,68Ga-DOTA-4P(FAPI)4、68Ga-DOTA-2P(FAPI)2和68Ga-FAPI-46的肿瘤摄取在注射后1 h差异无统计学意义,但注射后4 h肿瘤对68Ga-DOTA-4P(FAPI)4的摄取明显高于68Ga-DOTA-2P(FAPI)2[SUVmean, 1.99 ± 0.09 vs. 1.71 ± 0.10, P=0.018]和68Ga-FAPI-46[SUVmean, 1.99 ± 0.09 vs. 1.20 ± 0.07, P < 0.001]。
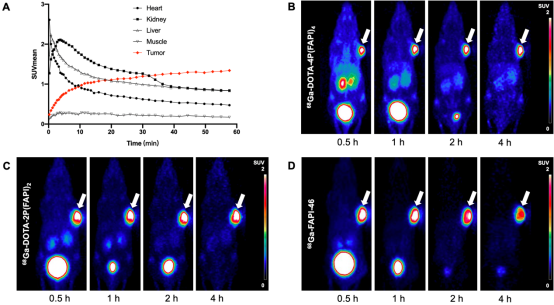
图3. 68Ga标记FAPI单体、二聚体和四聚体在HT-1080-FAP荷瘤鼠模型的PET显像及定量研究
在U87MG(人胶质母细胞瘤,肿瘤细胞中FAP阳性表达)荷瘤鼠模型中,三种放射性示踪剂的肿瘤摄取差异更为显著。如图4所示,U87MG肿瘤中68Ga-DOTA-4P(FAPI)4摄取(1 h p.i)约为68Ga-DOTA-2P(FAPI)2摄取的2倍(SUVmean, 0.72±0.02 vs. 0.42±0.03, P<0.001),较68Ga-FAPI-46摄取高4倍以上(SUVmean, 0.72±0.02 vs. 0.16±0.01, P<0.001)。此外,在注射后1H-4H期间,U87MG肿瘤中68Ga-DOTA-4P(FAPI)4和68Ga-DOTA-2P(FAPI)2的摄取基本稳定,而68Ga-FAPI-46在肿瘤中摄取随时间显著降低。
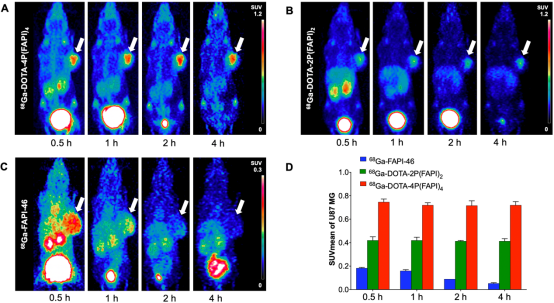
图4. 68Ga标记FAPI单体、二聚体和四聚体在U87MG荷瘤鼠模型的PET显像及半定量数据
为验证该四聚体探针与FAP结合的特异性,进行体内阻断实验评估。结果显示,用未标记的“冷前体”FAPI-46进行阻断后,在大多数器官中检测到68Ga-DOTA-4P(FAPI)4放射性的显著下降(图5),而肿瘤摄取的下降幅度最为显著(未阻断的SUVmean, 1.87±0.08 vs.阻断的SUVmean, 0.16±0.03;肿瘤摄取减少92%)。
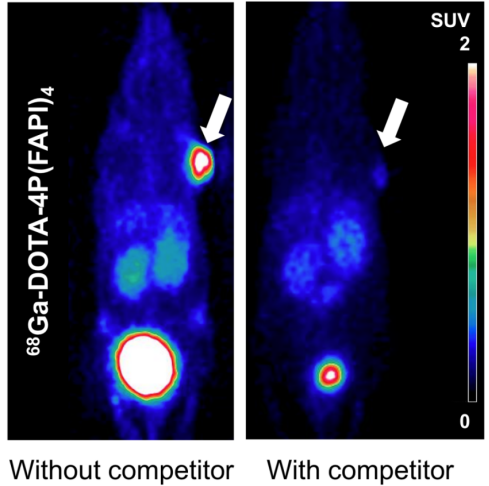
图5. 68Ga标记FAPI四聚体在HT-1080-FAP荷瘤鼠模型中显像及阻断显像
为观察放射性药物在体内的分布,以及在肿瘤病灶中的摄取和洗脱过程,使用半衰期较长的放射性核素(64Cu, t1/2 = 12.7 h)标记FAPI四聚体和二聚体,进行多时间点PET显像研究。实验结果显示,在所有扫描时间点内HT-1080-FAP肿瘤对64Cu-NOTA-4P(FAPI)4的摄取始终高于64Cu-NOTA-2P(FAPI)2,而64Cu-NOTA-4P(FAPI)4在肿瘤中的洗脱速度低于64Cu-NOTA-2P(FAPI)2 (图6)。在肾脏、肝脏中64Cu-NOTA-4P(FAPI)4的摄取亦高于64Cu-NOTA-2P(FAPI)2,而在其他非靶器官中的示踪剂摄取,两者基本相似。
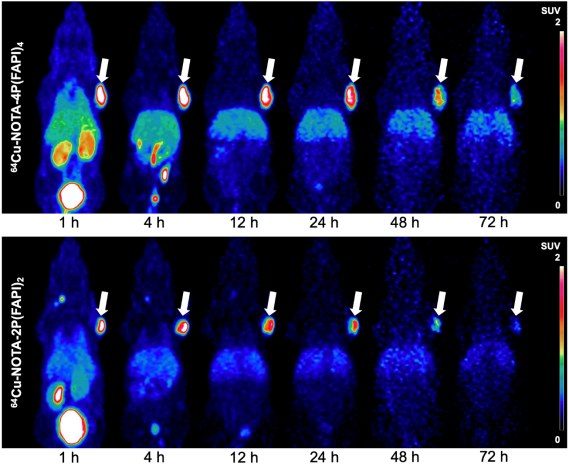
图6. 64Cu标记FAPI四聚体及二聚体在HT-1080-FAP荷瘤鼠模型中的PET显像
为了进一步评价该四聚体FAPI探针作为放射性治疗药物的可行性,利用诊疗一体化核素177Lu进行四聚体探针的放射性标记,并进行多时间点SPECT显像,探索177Lu-DOTA-4P(FAPI)4在肿瘤中的摄取及体内的分布特征。FAPI四聚体、二聚体和单体FAPI-46的代表性SPECT图像如图7所示。与64Cu-PET显像结果相似,177Lu-DOTA-4P(FAPI)4在HT-1080-FAP荷瘤鼠中的肿瘤摄取在各时间点均显著高于二聚体177Lu-DOTA-4P(FAPI)4和单体FAPI-46(图7)。生物分布实验的定量结果(图8)显示:177Lu-DOTA-4P(FAPI)4在注射后24 h的肿瘤摄取为21.1.4±1.7% ID/g,肿瘤清除相对缓慢 (48h、72h、96h分别为19.2±0.6% ID/g, 18.8±2.1% ID/g和14.8±0.9% ID/g)。二聚体177Lu-DOTA-2P(FAPI)2在注射后24 h的肿瘤摄取为17.1±3.9% ID/g,略低于四聚体177Lu-DOTA-4P(FAPI)4,但FAPI二聚体在肿瘤中的洗脱速度较FAPI四聚体更快,在48、72和96 h时的摄取值分别为18.8±4.1% ID/g、13.8±2.6% ID/g和13.1±0.7% ID/g。单体177Lu-FAPI-46经尾静脉注射后24 h的肿瘤摄取显著低于177Lu-DOTA-4P(FAPI)4 (3.4±0.7% ID/g, P<0.001)。
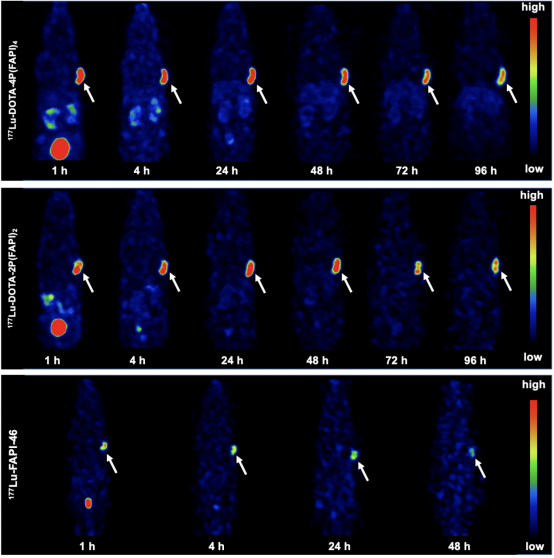
图7. 177Lu标记FAPI四聚体、二聚体和单体在HT-1080-FAP荷瘤鼠模型的SPECT显像
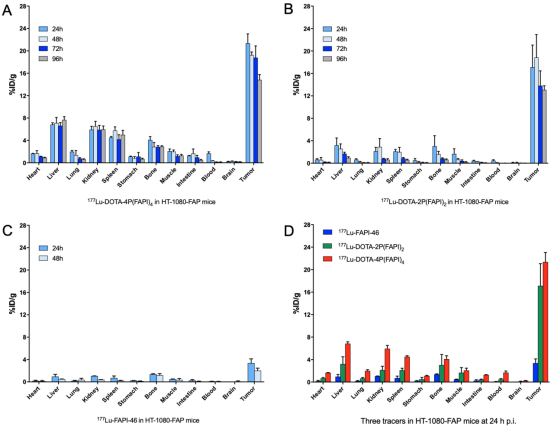
图8. 177Lu标记FAPI四聚体、二聚体和单体在HT-1080-FAP荷瘤鼠模型中的生物分布实验
在完成体内核素显像评估后,作者分别在HT-1080-FAP和U87MG两种荷瘤鼠模型中进行177Lu 放射靶向治疗实验(Radioligand therapy,图9)。核素治疗实验结果显示,在HT-1080-FAP(图9A)及U87MG两种荷瘤鼠模型中(图9B),177Lu-DOTA-4P(FAPI)4的治疗效果明显优于177Lu-FAPI-46和177Lu-DOTA-2P(FAPI)2。
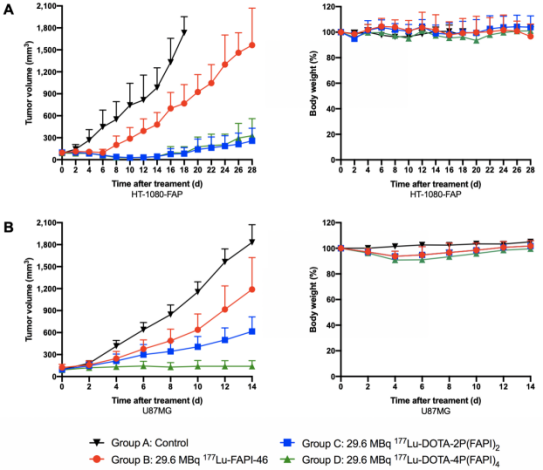
图8. 177Lu标记FAPI四聚体、二聚体和单体在HT-1080-FAP荷瘤鼠模型和U87MG荷瘤鼠模型的放射性配体治疗实验
总结
本研究中,作者针对成纤维细胞激活蛋白(FAP)靶向分子肿瘤摄取和滞留的改构优化问题,利用多价效应成功构建了基于FAPI的四聚体放射性探针,通过一系列的临床前研究评价了其在体外与FAP的亲和力、体内药代动力学特性,及在荷瘤鼠模型中的放射性靶向治疗效果。本研究结果表明放射性标记的FAPI四聚体较单体FAPI-46在肿瘤摄取和滞留时间方面均有较大程度提升。177Lu-DOTA-4P(FAPI)4在HT-1080-FAP及U87MG荷瘤裸鼠模型中显示出了良好的抗肿瘤疗效。这种多聚化研究策略有望为靶向FAP放射性探针的优化策略提供新的研究方向,为将来FAP放射靶向治疗的发展提供了一种新的研究思路。