我院近期发表在临床医学TOP期刊《Journal of Clinical Investigation》中的临床医学研究(Clinical Medicine),题目为 “68Ga-MY6349 PET/CT imaging to assess Trop2 expression in multiple types of cancer”。在这篇文章中,研究团队开发了一种可特异性靶向Trop2的放射性分子探针68Ga-MY6349,并进行了探索性的临床转化研究,用于多种肿瘤的PET/CT分子成像,评估68Ga-MY6349 PET/CT用于无创检测肿瘤Trop2表达的可行性。本文的通讯作者是厦门大学附属第一医院的陈皓鋆教授及王占祥教授、北京大学医学部的王凡教授;第一作者是厦门大学附属第一医院核医学科赵亮主治医师、逄一臻博士和中国科学院生物物理研究所史继云研究员。

研究背景
滋养层细胞表面抗原2(Trop2)是一种跨膜糖蛋白,在大多数肿瘤中高表达,而在正常组织中不表达或低表达。Trop2表达水平的升高与肿瘤细胞增殖和侵袭能力的增强密切相关,同时在多种癌症中被视为不良预后的标志。因此,Trop2是临床肿瘤诊疗中的重要靶点。
Sacituzumab govitecan(SG)是一种靶向Trop2的抗体-药物偶联物(ADC),已获美国食品药品监督管理局(FDA)批准用于治疗转移性三阴性乳腺癌、激素受体阳性(HR+)乳腺癌及转移性尿路上皮癌。III期临床试验ASCENT研究结果显示,SG的疗效与肿瘤组织Trop2表达程度密切相关。这进一步强调了对肿瘤Trop2表达进行全面、精准评估的重要性,以便根据患者Trop2表达水平进行分层,实现个体化治疗。目前,晚期肿瘤患者的Trop2表达检测主要依赖单一病灶活检标本的免疫组化染色,但此方法在克服肿瘤的时间和空间异质性方面存在局限。无创的核医学成像技术(如PET/SPECT)有望克服这些不足,并可在治疗过程中实时监测Trop2表达的动态变化,为后续治疗提供指导。
在本研究中,研究团队开发了一种可特异性靶向Trop2的放射性示踪剂68Ga-MY6349,用于多种类型肿瘤的PET/CT成像,随后与18F-FDG PET/CT进行了头对头比较。本研究的主要目的是评估68Ga-MY6349 PET/CT用于无创检测肿瘤Trop2表达的可行性,从而驱动靶向Trop2 ADC药物的精准治疗;次要目的是通过与18F-FDG PET/CT进行头对头比较,探索68Ga-MY6349 PET/CT在某些肿瘤诊断中的临床优势,为肿瘤的诊断分期提供新的分子影像学方法。
研究结果
68Ga-MY6439的制备和临床前研究
Trop2靶向纳米抗体MY6349经过定点修饰并与68Ga进行标记(图1A),具有良好的放化纯、比活度和稳定性。在细胞系的Trop2表达分析中,BxPC-3细胞表现出最高的Trop2表达水平,HCC1937和C666-1次之,而A549阴性表达。此外,通过流式细胞术和共聚焦显微镜观察到FITC-MY6349和Trop2全长抗体的共定位,验证了MY6349对Trop2的特异性。68Ga-MY6349在Trop2阳性细胞系上表现出高效结合,并且在加入未标记的MY6349和完整的Trop2抗体后,结合显著受抑制,而在Trop2阴性的A549细胞上几乎无结合。体外实验显示68Ga-MY6349对Trop2具有高亲和力,50%抑制浓度(IC50)为1.82 nM,平衡解离常数(Kd)为11.65 nM(图1B–C)。
小鼠PET成像显示68Ga-MY6349在注射后0.5小时迅速在BxPC-3肿瘤中积聚,且可维持至注射后3小时。加入过量未标记MY6349后肿瘤摄取显著减少,进一步证明了68Ga-MY6349的特异性(图1D)。生物分布实验结果与显像结果类似(图1E),且PET半定量数据与生物分布定量数据呈显著一致性(R² = 0.9726, P < 0.0001)(图1F)。免疫组化结果也与68Ga-MY6349的PET成像结果趋势一致(图1G-I),强调了68Ga-MY6349 PET/CT在体内准确反映Trop2表达的能力。
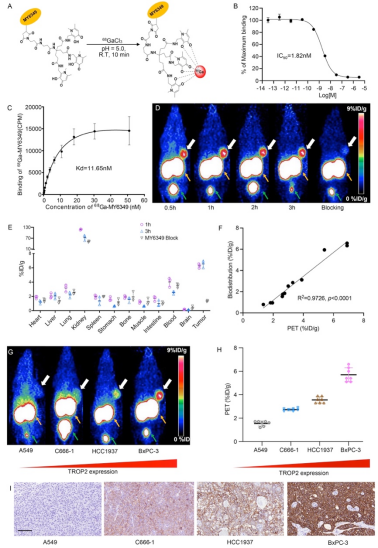
图1. 68Ga-MY6439的制备及临床前评价。(A)MY6349与68Ga的放射性标记。(B-C)通过半抑制浓度和平衡解离常数分析68Ga-MY6439对Trop2的结合亲和力。(D)在BxPC-3肿瘤模型中的68Ga-MY6439 PET成像及阻断实验(黄色箭头:肾脏;绿色箭头:膀胱)。(E)在有或无未标记MY6349同时注射条件下,68Ga-MY6439的体内分布定量结果。(F)PET感兴趣区域(ROI)与生物分布研究(%ID/g)的相关性。(G-H)A549、C666-1、HCC1937和BxPC-3荷瘤小鼠在注射后1小时的代表性PET成像及定量结果,显示Trop2特异性肿瘤摄取。黄色箭头:肾脏;绿色箭头:膀胱。(I)对应肿瘤的Trop2免疫组化染色。比例尺:100 μm。
患者特征、安全性评价及人体分布
在2024年1月至8月开展的该临床转化研究中(NCT06188468),前瞻性招募了90名接受68Ga-MY6349 PET/CT的患者,涉及15种肿瘤亚型(图2)。90名患者中,78名进行了68Ga-MY6349与18F-FDG PET/CT的配对扫描,12名前列腺癌患者进行了68Ga-MY6349和68Ga-PSMA-11 PET/CT的配对扫描。45名初治患者接受PET/CT用于肿瘤分期,另45名患者接受PET/CT用于肿瘤复发和转移的诊断。67例患者的诊断通过病理(来自活检或手术标本)确诊,其余23例通过影像和/或临床随访确诊。
所有参与者均良好耐受68Ga-MY6349,注射后至4小时随访期间无不良事件发生。68Ga-MY6349的有效剂量为1.46E−02 mSv/MBq,血池摄取随时间减少,注射后60分钟获得了良好的肿瘤与背景比(TBR)。药物体内分布主要在肾脏、胰腺、唾液腺和甲状腺。
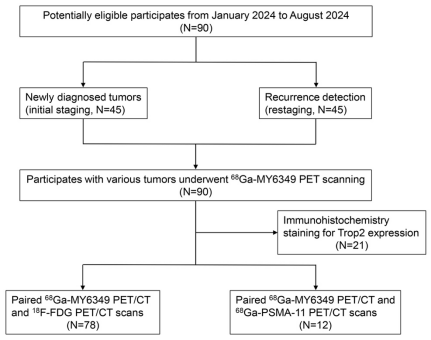
图2. 临床研究的流程图
68Ga-MY6349 PET/CT用于15种肿瘤的PET/CT成像
本研究入组的90例肿瘤患者中,共包括55个原发肿瘤和779个复发/转移灶。68Ga-MY6349在原发病灶与转移病灶的显像剂摄取值(以SUVmax作为半定量参数)无显著差异(图3A)。对多种肿瘤的68Ga-MY6349摄取分析(图3B)显示,SUVmax >10(高度摄取)的肿瘤类型包括三阴性乳腺癌、HR+乳腺癌、前列腺癌和甲状腺乳头状癌(PTC)。SUVmax在5–10(中等程度摄取)之间的肿瘤类型包括HER2+乳腺癌、妇科肿瘤、食管癌、非小细胞肺癌、尿路上皮癌、鼻咽癌和头颈癌。SUVmax <5(低度摄取)的肿瘤包括结直肠癌、甲状腺髓样癌、胰腺癌和甲状腺滤泡癌。为评估Trop2表达异质性能否通过Trop2靶向PET/CT可视化,我们分析了同一患者不同病灶之间68Ga-MY6349的摄取(图3C)。在38名多发病灶(>10个病灶)的患者中观察到SUVmax的个体内异质性,中位倍数差异为4.5(范围1.8–20.6),中位变异系数为38.9%(范围19.1–84.0%)。图3D展示了患者个体内Trop2表达异质性的典型病例,该患者的颈部复发病灶(Trop2阴性,SUVmax 1.7)与肺转移灶(Trop2阳性,SUVmax 13.7)的68Ga-MY6349摄取程度不同。图3D还显示,18F-FDG PET/CT可以检测到转移性肿瘤,但无法反映肿瘤中Trop2的表达。
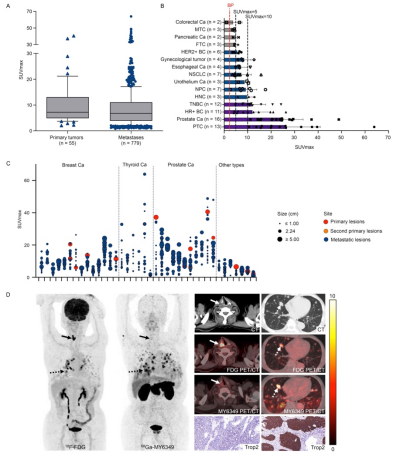
图3. 不同肿瘤病灶中的68Ga-MY6349摄取。(A)68Ga-MY6349 PET/CT中原发和转移性肿瘤SUVmax值无显著差异。(B)基于68Ga-MY6349 PET/CT在15种肿瘤中的平均SUVmax值,显示低、中、高摄取的分布,分别以SUVmax = 5和10作为界限。背景(血池)的SUV平均值为2.1。(C)38名患者中68Ga-MY6349摄取的SUVmax概览,包括15个原发灶、1个第二原发灶和665个转移病灶。同时显示同一患者中不同病灶的SUVmax值、肿瘤大小和部位。(D)患者(转移性甲状腺癌)PET/CT成像显示右颈部复发肿瘤(实箭头)和肺转移病灶(虚箭头)中68Ga-MY6349摄取的差异,反应Trop2表达的异质性。同一患者进行18F-FDG和68Ga-MY6349 PET/CT扫描。
68Ga-MY6349从血池中快速清除,导致注射后1小时背景活性较低,血池中平均SUVmax为2.1,肌肉组织中平均SUVmax为0.7。这种清除使大多数肿瘤类型的TBR > 3,从而能够清晰勾勒出肿瘤轮廓,从而提高PET/CT诊断准确性(图4)。
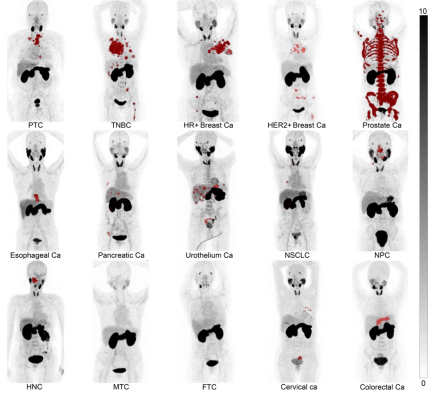
图4. 68Ga-MY6349在15种不同肿瘤的PET/CT表现。PTC = 甲状腺乳头状癌,TNBC = 三阴性乳腺癌,HR+ BC = 激素受体阳性乳腺癌,HER2+ BC = 人表皮生长因子受体2阳性乳腺癌,Ca = 癌,NSCLC = 非小细胞肺癌,NPC = 鼻咽癌,HNC = 头颈癌,MTC = 甲状腺髓样癌,FTC = 甲状腺滤泡状癌。
我们分析了21份组织活检标本(包括12个原发肿瘤和9个转移病灶)的Trop2 IHC染色。根据III期临床试验ASCENT研究中的H评分法评估Trop2表达。标本中6份为Trop2低表达(H评分<100),9份为中等表达(H评分100–200),6份为高表达(H评分200–300)。68Ga-MY6349肿瘤摄取与Trop2表达水平呈正相关(图5A-B,P < 0.001),两者呈线性关系,决定系数R²为0.7757,P < 0.001(图5C)。
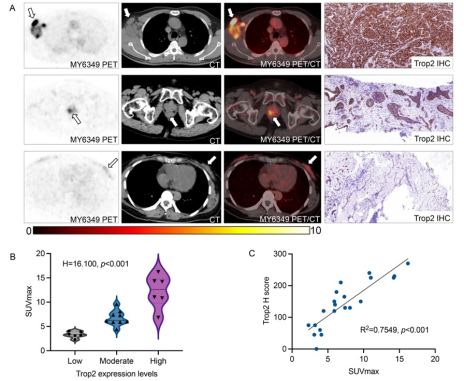
图5. 68Ga-MY6349肿瘤摄取与Trop2表达水平的相关性分析。(A)来自不同肿瘤类型、具有不同Trop2表达分数的患者的代表性68Ga-MY6349 PET/CT图像和免疫组化染色组织样本(白色箭头指示肿瘤病灶)。上排:初诊的TNBC患者;中排:初诊的前列腺癌患者;下排:初诊的HER2+乳腺癌患者。不同Trop2表达水平的肿瘤病灶表现出不同的68Ga-MY6349摄取程度。第一例:SUVmax 16.2,Trop2 H评分270;第二例:SUVmax 9.6,Trop2 H评分150;第三例:SUVmax 4.1,Trop2 H评分45。(B)使用Kruskal-Wallis检验确定SUVmax与Trop2表达的显著相关性(H = 16.100,P < 0.001)。(C)基于简单线性回归的SUVmax与Trop2 H评分的相关性(R² = 0.7549,P < 0.001)。
68Ga-MY6349与18F-FDG PET/CT在不同肿瘤中的临床诊断效能
由于68Ga-MY6349在许多上皮起源肿瘤中的摄取显著高于正常器官,我们进一步分析了68Ga-MY6349 PET/CT对不同类型肿瘤的诊断效果,并将其与临床常用的18F-FDG PET/CT进行了对比。在原发性肿瘤的诊断中,68Ga-MY6349与18F-FDG在鼻咽癌、HR+乳腺癌、HER2+乳腺癌、三阴性乳腺癌、食管癌、非小细胞肺癌、妇科肿瘤和前列腺癌的显像剂摄取值无统计学差异。然而,在HR+乳腺癌中,68Ga-MY6349 PET/CT的TBR显著优于18F-FDG PET/CT(11.0 vs. 4.0,P = 0.002),检测到的乳腺肿瘤病灶数目更多(14 vs. 12)。在HER2+乳腺癌、尿路上皮癌和前列腺癌中也观察到类似结果,68Ga-MY6349 PET/CT显示出更高的TBR并检测到更多肿瘤病灶。
在复发和转移性肿瘤的检测方面,68Ga-MY6349 PET/CT在甲状腺乳头状癌、前列腺癌和HR+乳腺癌中的SUVmax和TBR均高于18F-FDG PET/CT,因此能够识别出更多的转移病灶,特别是在检测淋巴结转移(如甲状腺乳头状癌)、骨转移(如HR+乳腺癌)和肝转移(如尿路上皮癌)方面表现突出。代表性病例见图6A-C。在三阴性乳腺癌患者的68Ga-MY6349 PET/CT中,尽管TNBC病灶对68Ga-MY6349的SUVmax与18F-FDG相似,但TBR显著更高,使其能够检测到更多隐匿性或微小转移病灶(135 vs. 123),尤其是在肝脏和骨转移的检测上(图6D)。相反,18F-FDG PET/CT在鼻咽癌、HER2+乳腺癌、食管癌、胰腺癌和妇科肿瘤中具有更高的SUVmax,并检测到更多转移病灶。上述结果显示,68Ga-MY6349 PET/CT在甲状腺癌、前列腺癌、乳腺癌、尿路上皮癌等肿瘤的诊断中具有良好的临床应用前景,有望为现有的影像技术提供有效补充。
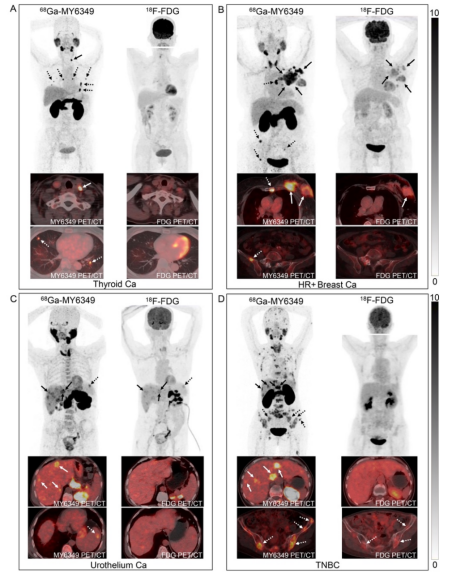
图 6. 不同肿瘤患者18F-FDG和68Ga-MY6349的代表性PET/CT图像。(A)一例68岁女性甲状腺乳头状癌,一年前接受手术切除,PET/CT检测肿瘤复发。68Ga-MY6349 PET/CT显示颈部淋巴结(实箭头)和肺部转移(虚箭头)高度摄取,而18F-FDG PET/CT为假阴性。(B)一例74岁女性激素受体阳性乳腺癌患者,接受PET/CT进行肿瘤分期。68Ga-MY6349 PET/CT在原发肿瘤(实箭头)、淋巴结和骨转移(虚箭头)中显示出较18F-FDG PET/CT更高的示踪剂摄取。此外,18F-FDG PET/CT在骨转移中为假阴性。(C)一例63岁男性尿路上皮癌(膀胱癌)患者接受PET/CT进行分期。68Ga-MY6349 PET/CT在原发和转移病灶中显示了较18F-FDG PET/CT更高的示踪剂摄取和更好的图像对比,特别是肝脏转移(实箭头)和脾转移(虚箭头)。(D)一例65岁女性三阴性乳腺癌患者,多线治疗后进展,接受PET/CT进行再分期。68Ga-MY6349 PET/CT在淋巴结、肝脏(实箭头)和广泛骨转移(虚箭头)中显示出明显的示踪剂摄取,而18F-FDG PET/CT在大多数转移病灶中显示低至中等摄取。
68Ga-MY6349 PET/CT与68Ga-PSMA-11 PET/CT在前列腺癌中的成像比较
我们将68Ga-MY6349与另一种经FDA批准的前列腺癌PET示踪剂68Ga-PSMA-11进行了头对头比较。在12例经病理确诊的前列腺癌患者中,68Ga-MY6349 PET/CT在原发及转移病灶中表现出与68Ga-PSMA-11相似的显像剂摄取,但在转移病灶中表现出较68Ga-PSMA-11更高的靶/本底比(TBR),从而有利于检测到更多的骨转移病灶(病灶数目:122 vs. 101),并表现与68Ga-PSMA-11相当的淋巴结转移检出率(病灶数目:61 vs. 60)。图7展示了68Ga-MY6349 PET/CT相较于68Ga-PSMA-11 PET/CT优越性的代表PET/CT病例。
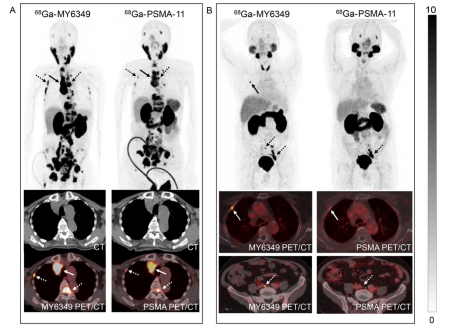
图7. 68Ga-MY6349 PET/CT和68Ga-PSMA-11 PET/CT在转移性前列腺癌患者中的代表性图像。(A)一名77岁男性前列腺癌患者,接受内分泌治疗后进行PET/CT成像再分期。相比68Ga-PSMA-11,68Ga-MY6349 PET/CT显示了更多的转移病灶,并在淋巴结转移(实箭头)和骨转移(虚箭头)中具有更高的示踪剂摄取(SUVmax 30-40)。(B)一名70岁男性患者,病理确诊为前列腺癌,接受PET/CT进行初始分期。68Ga-MY6349 PET/CT在右侧肋骨转移(实箭头)和腹膜后微小转移淋巴结(4mm,虚箭头)中显示出较68Ga-PSMA-11更高的示踪剂摄取。
研究结论
本研究开发了一种特异性靶向Trop2的放射性分子探针68Ga-MY6349,实现了以PET显像中肿瘤对于分子探针的特异摄取反映肿瘤Trop2的表达水平,有望直接通过PET/CT影像筛选Trop2-ADC治疗优势人群,提高ADC治疗效益,也为相应ADC药物临床适应症的选择提供分子影像精准评估方法。此外,本研究还发现68Ga-MY6349有望成为一种广谱肿瘤显像剂,68Ga-MY6349 PET/CT为肿瘤的诊断分期与复发/转移检测提供了一种全新的分子影像方法,尤其在甲状腺癌、前列腺癌、乳腺癌和尿路上皮癌的诊断中,能够有效弥补现有18F-FDG PET/CT的不足。
原文链接:https://www.jci.org/articles/view/185408
通讯作者

陈皓鋆,厦门大学附属第一医院核医学科,教授,副主任医师,博士生导师,国家优秀青年科学基金获得者。研究方向为核医学显像及治疗的临床转化。担任核医学顶刊J Nucl Med编委、 Eur J Nucl Med Mol Imaging编委、《中华核医学与分子影像杂志》编委;主持国家自然科学基金3项,并主持福建省杰出青年科学基金、福建省卫健委重大项目。入选中国研究型医院评价遴选“研究型人才”、福建省卫健委“高层次领军人才”;荣获中华医学会核医学分会“希望之星”、北美核医学与分子影像学会“青年科学家”奖(SNMMI Ones to Watch,全球30名)。以第一/通讯作者在Clin Cancer Res、Radiology等行业顶刊发表SCI论文40余;以第一发明人获国家发明专利3项、美国发明专利1项;获福建省科技进步三等奖(第一完成人)、厦门市科技进步二等奖(第一完成人)、上海市医学科技二等奖(第二完成人)。

王占祥,厦门大学附属第一医院院长。医学博士、主任医师、教授、博士生导师。“中国医师奖”获得者,国务院特殊津贴专家。从事临床医学研究与疾病救治工作近40年,曾留学日本,多次到美国哈佛大学,英国牛津大学等国际知名学术机构进行交流访问,先后获得福建省优秀归国人员,福建省突出贡献中青年专家,福建省优秀共产党员,入选福建省新世纪百千万人才工程。厦门市重点引进留学归国人才,厦门市杰出科技人才,厦门市领军人才,首届厦门市医学学术与技术带头人,厦门市脑科中心学科带头人。2022年被评为厦门经济特区建设40周年创新创业人物。厦门市科学技术重大贡献奖获得者。
第一作者

赵亮,厦门大学附属第一医院核医学科&闽南PET中心主治医师。以第一/通讯作者在Radiology、J Nucl Med(6篇)、Eur J Nucl Med Mol Imaging(7篇)、Signal Transduction and Targeted Therapy、Theranostics等国际权威期刊发表论著28篇(5篇入选ESI高被引论文)、个案报道8篇,H影响因子23,累计被引超过2200次。连续入选2022、2023全球“前2%顶尖科学家”榜单(world’s top 2% scientists),获得2023、2024年北美核医学与分子影像学会Alavi-Mandell奖,2024年北美核医学与分子影像年会国际最佳摘要和旅行奖,并以主要完成人获厦门市科技进步二等奖、福建省科技进步三等奖、福建省抗癌协会科技进步奖二等奖。

逄一臻,厦门大学2021级肿瘤学博士研究生,导师为厦门大学附属第一医院林勤教授和陈皓鋆教授,硕博在读期间以第一作者/共同第一作者在Radiology、J Nucl Med、Eur J Nucl Med Mol Imaging、Signal Transduction and Targeted Therapy等国际权威期刊发表研究论文多篇。曾获硕士及博士研究生国家奖学金、厦门大学三大奖本栋奖学金,获得2021欧洲核医学会(EANM)“年度最佳论文奖”、2024年北美核医学协会Alavi-Mandell奖,以共同完成人身份获厦门市科技进步二等奖、福建省抗癌协会科技进步奖二等奖。