今天为大家分享一篇近期发表于免疫学领域Top期刊《Journal for ImmunoTherapy of Cancer》题目为 “FAP-targeted radioligand therapy with 68Ga/177Lu-DOTA-2P(FAPI)2 enhance immunogenicity and synergize with PD-L1 inhibitors for improved antitumor efficacy” 的研究成果。在本研究中, 作者团队探讨了68Ga/177Lu-DOTA-2P(FAPI)2 作为免疫调节剂在微卫星稳定型结直肠癌(MSS-CRC)小鼠模型中的免疫调节潜力。本研究旨在对比评估68Ga/177Lu-DOTA-2P(FAPI)2是否能增强MSS-CRC对PD-1/PD-L1免疫治疗敏感性及治疗疗效, 并探索其潜在机制。本文的通讯作者是厦门大学附属第一医院陈皓鋆教授、赵亮主治医师、苏国强教授及新加坡国立大学陈小元教授;厦门大学医学院博士研究生陈健豪、周扬帆、逄一臻为该论文的共同第一作者。

原文链接:https://jitc.bmj.com/content/13/1/e010212.info
研究背景
免疫治疗的突破性进展在一定程度上改变了癌症治疗格局。其中,免疫检查点抑制剂(ICI),尤其是 PD-1/PD-L1抑制剂,显著提升了部分晚期癌症患者的生存率。尽管部分患者在接受ICI 治疗后出现肿瘤完全消退,但大量临床试验结果表明,单纯接受 ICI 治疗的肿瘤患者总体反应率仅为20%-30%。既往研究表明,微卫星不稳定型(MSI)CRC 患者,因其较高的肿瘤突变负荷与更强的免疫激活状态,对PD-1/PD-L1 阻断等免疫疗法更为敏感,而微卫星稳定型(MSS)结直肠癌(CRC)患者,由于其较低的肿瘤突变负荷与免疫激活水平,对这类治疗响应欠佳。因此,开发安全有效的联合治疗策略,对改变MSS-CRC的肿瘤微环境(TME)、提高其对PD-1/PD-L1等免疫疗法的敏感性至关重要。
靶向放射性核素治疗(TRT)为治疗广泛转移性肿瘤患者开辟了新路径。相较于传统外照射放疗(EBRT),TRT 能够精准靶向肿瘤细胞并递送辐射,最大程度降低对健康组织的损伤。在肿瘤学研究领域,治疗性与诊断性放射性核素均举足轻重,不过二者对TME 的影响各不相同。 177Lu、90Y 和 211At 等治疗性放射性核素,因其能持续释放辐射而直接杀伤或抑制肿瘤细胞而备受重视。在作者团队的前期研究中,使用 177Lu-EB-RGD 靶向 MC38 结直肠肿瘤小鼠肿瘤病灶中的整合素 αvβ3,成功使TME中免疫细胞浸润增加、PD-L1 表达上调,且与 αPD-L1 mAb联用时,“内照射-免疫”联合治疗显著增强了抗肿瘤效果。相比之下,18F、68Ga 和 99mTc 等诊断性放射性核素则主要应用于临床诊断。理论上,诊断性放射性核素在较高剂量下,也可通过释放正电子损伤肿瘤细胞DNA,诱导肿瘤细胞凋亡或坏死,进而产生细胞毒性效应。新近的一篇临床前研究显示,正电子显像剂18F-FDG 能够诱导荷瘤小鼠肿瘤细胞凋亡与坏死,上调肿瘤细胞 PD-L1 表达,重塑 TME,联合 αPD-L1 mAb治疗时疗效显著提升,使之成为极具潜力的肿瘤治疗新选择。此外,有研究指出,18F 释放的正电子(β +)能量约为 0.633 MeV,与 131I 释放的电子(β -)能量 0.606 MeV 相近;而 68Ga 释放的β + 能量约 1.9 MeV,接近 18F 的三倍。这些研究均提示,诊断性放射性核素68Ga有望成为增强ICI治疗疗效的潜在佐剂。然而,目前尚无相关研究对比评估治疗性和诊断性放射性核素对TME的调节作用及抗肿瘤效能。
成纤维细胞激活蛋白(FAP)是放射性药物研发的关键靶标之一。针对FAP的放射性药物,如177Lu或90Y标记的FAP抑制剂 (FAPI)分子(FAPI-04和FAPI-46),已在多种晚期肿瘤患者中进行评估,且显示出良好的安全性,并有潜力治疗难治性癌症。然而,这些初步研究的治疗效果仍然有限,主要是因为当前FAPI分子在肿瘤中的滞留时间相对较短。作者团队前期研发了一种新型靶向FAP的二聚体分子探针DOTA-2P(FAPI)2,在临床前和初步临床研究中显示出更高的FAP靶向效能,能够增加肿瘤摄取和延长肿瘤滞留时间。在后续的治疗实验中,使用177Lu-DOTA-2P(FAPI)2进行TRT也显示出优于单体177Lu-FAPI-46的抗肿瘤效果。
本研究中,作者团队聚焦于探究 68Ga-DOTA-2P(FAPI)2和177Lu-DOTA-2P(FAPI)2作为免疫调节剂在 MSS-CRC 荷瘤小鼠模型中的免疫调节潜能,旨在确定这种新型靶向 FAP 的二聚体化合物能否增强 MSS-CRC对 PD-1/PD-L1 免疫治疗的敏感性,并探索其潜在机制。作者团队推测,该策略有望重塑 MSS-CRC 免疫抑制性的TME,使之向有利于免疫治疗的方向转变,从而改善治疗效果。
研究结果
对68Ga/177Lu标记的FAPI二聚体DOTA-2P(FAPI)2进行的体外和体内实验结果显示,在10-60min内,FAP阳性表达的CT26-FAP肿瘤细胞对68Ga-DOTA-2P(FAPI)2的摄取逐渐增加。在CT26-FAP荷瘤小鼠模型的肿瘤中表现出明显的放射性摄取和持久的肿瘤滞留(图 1)。此外,68Ga-DOTA-2P(FAPI)2和177Lu-DOTA-2P(FAPI)2两种放射性药物均上调了肿瘤细胞的PD-L1表达以及肿瘤细胞DNA双链断裂的增加,但177Lu-DOTA-2P(FAPI)2效果更加显著(图 2)。在抗肿瘤治疗中,对CT26-FAP荷瘤小鼠(n=6/组)进行对照组、αPD-L1 mAb组、68Ga-DOTA-2P(FAPI)2组、177Lu-DOTA-2P(FAPI)2组和联合疗法组进行疗效对比。68Ga-DOTA-2P(FAPI)2联合αPD-L1 mAb免疫疗法的联合治疗方案在一定程度上延缓了CT26-FAP的肿瘤生长,而177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb免疫疗法的联合治疗方案使100% CT26-FAP荷瘤小鼠的肿瘤病灶完全缓解。此外,小鼠在治愈3个月后再次接种肿瘤细胞时,表现出100%的肿瘤排斥(图 3)。
使用免疫组织化学(IHC)染色、单细胞RNA测序(scRNA-seq)分析CT26-FAP荷瘤小鼠的TME变化情况。IHC结果与scRNA-seq一致显示,在177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb的联合治疗方案中,肿瘤免疫微环境发生了显著变化,肿瘤内浸润的T细胞数量增加,其中效应T细胞亚群比例的增幅最大,这与其最佳治疗效果和持久的免疫记忆相关。此外,scRNA-seq数据还表明,在177Lu-DOTA-2P(FAPI)2单药组及177Lu-DOTA-2P(FAPI)2与αPD-L1 mAb的联合治疗组中,经治疗后TME中的自然杀伤细胞(NK细胞)比例均有所增加,抗肿瘤相关的FASLG通路显著上调,而促肿瘤的SPP1通路则显著下调(图4、5)。以上数据表明,177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb免疫疗法的治疗方案在逆转肿瘤免疫抑制微环境以及阻止肿瘤细胞各亚群增殖方面更为有效。
此外,本研究scRNA-seq数据显示,177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb的治疗方案显著提高了肿瘤内中性粒细胞的比例。作者团队通过从BALB/c小鼠的骨髓中提取并刺激中性粒细胞,再将N1中性粒细胞与CT26-FAP细胞共培养后,利用ATP发光细胞活力检测法以及钙黄绿素AM/碘化丙啶(Calcein AM/PI)细胞染色检测法对细胞毒性作用进行了评估。结果显示,在共培养体系中,CT26-FAP细胞的活力显著下降,死亡的CT26-FAP细胞数量增加。在进一步阻断了CT26-FAP荷瘤小鼠肿瘤内的中性粒细胞后,177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb的抗肿瘤疗效发生了显著抑制。进一步的研究数据表明,在联合治疗组中,与促炎细胞因子相关的白细胞介素1α(Il1a) 阳性和趋化因子受体2(Cxcr2) 阳性的成熟中性粒细胞亚群比例高于其他组(图6)。综上,本研究结果提示,177Lu-DOTA-2P(FAPI)2联合 αPD-L1 mAb免疫治疗的联合方案中,肿瘤内的成熟中性粒细胞是发挥协同抗肿瘤效应的重要效应细胞。
研究结论
靶向FAP的放射性药物68Ga/177Lu-DOTA-2P(FAPI)2 ,尤其是177Lu-DOTA-2P(FAP)2,具有显著增强PD-1/PD-L1抗肿瘤疗效的潜力,为增强MSS-CRC对PD-1/PD-L1抑制剂的临床疗效提供了一种潜在可行的新方法。后续将有待进一步的临床转化研究,评估177Lu-DOTA-2P(FAP)2与PD-1/PD-L1单抗的联合治疗方案在MSS-CRC中的有效性,有望改写临床对MSS-CRC的治疗格局。
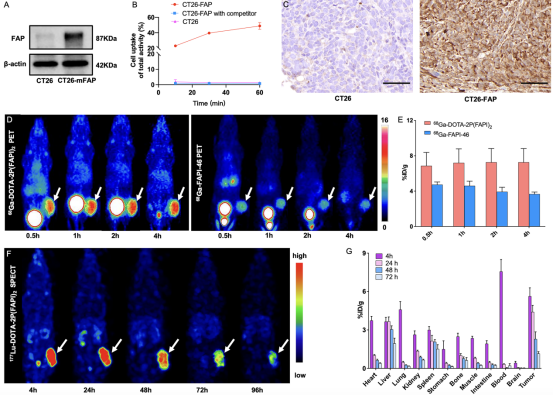
图1. 68Ga/177Lu标记的DOTA-2P(FAPI)2的体外及体内生物学评价。(A)使用Western blot检测 CT26-FAP细胞中的纤维细胞激活蛋白(FAP)表达。(B)在CT26-FAP和CT26肿瘤细胞上进行68Ga-DOTA-2P(FAPI)2的细胞摄取和阻断实验。(C)CT26-FAP肿瘤组织中FAP的免疫组织化学染色。比例尺: 50 μm。(D)CT26-FAP肿瘤小鼠中68Ga-DOTA-2P(FAPI)2和68Ga-FAPI-46的代表性静态PET图像。(E)CT26-FAP肿瘤小鼠中68Ga-DOTA-2P(FAPI)2和68Ga-FAPI-46的PET 定量数据。(F)CT26-FAP肿瘤小鼠中177Lu-DOTA-2P(FAPI)2从注射后4小时到96小时的 SPECT MIP图像。(G)CT26-FAP肿瘤小鼠中177Lu-DOTA-2P(FAPI)2从注射后4小时到72小时的生物分布结果(n=3/组)。
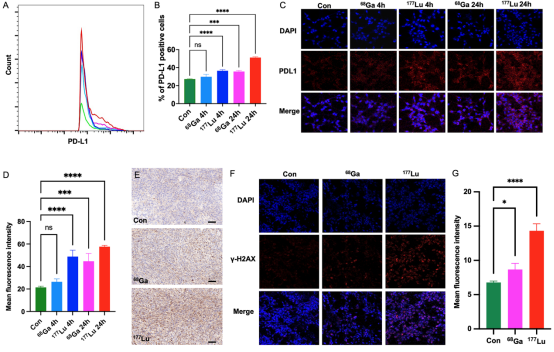
图2 68Ga/177Lu-DOTA-2P(FAPI)2在体外和体内显著上调肿瘤PD-L1表达。(A) 流式细胞术评估和分析CT26-FAP肿瘤细胞在68Ga/177Lu-DOTA-2P(FAPI)2刺激后不同时间点的PD-L1表达增加。(B) 代表性直方图显示68Ga/177Lu-DOTA-2P(FAPI)2刺激后PD-L1的上调水平(n=3/组)。(C) CT26-FAP肿瘤细胞与68Ga/177Lu-DOTA-2P(FAPI)2共孵育后不同时间点的PD-L1免疫荧光染色共聚焦图像。(D) 代表性直方图显示68Ga/177Lu-DOTA-2P(FAPI)2刺激后PD-L1的上调(n=3/组)。(E) 肿瘤组织中PD-L1的免疫组织化学染色。比例尺:50 µm。(F) CT26-FAP肿瘤细胞与68Ga/177Lu-DOTA-2P(FAPI)2共孵育后γ-H2AX免疫荧光染色的共聚焦图像。(G) 代表性直方图显示68Ga/177Lu-DOTA-2P(FAPI)2刺激后γ-H2AX的上调水平(n=3/组)。
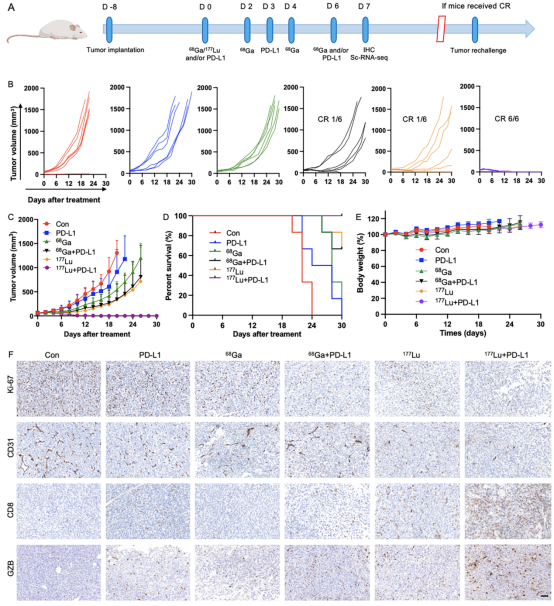
图3 68Ga/177Lu-DOTA-2P(FAPI)2放射性配体治疗联合αPD-L1 mAb免疫治疗显著增强抗肿瘤疗效。(A)展示了对CT26-FAP荷瘤小鼠的治疗方案和时间线。(B)不同治疗组的CT26-FAP肿瘤小鼠的个体肿瘤生长轨迹(n=6/组)。(C)各组肿瘤生长曲线。(D)各组生存率。(E)不同治疗组CT26-FAP肿瘤小鼠的体重变化图(n=6/组)。(F)对治疗7天后的肿瘤组织中Ki-67、CD31、CD8+T细胞和GZMB进行免疫组化染色。比例尺: 50 μm。CR,完全缓解。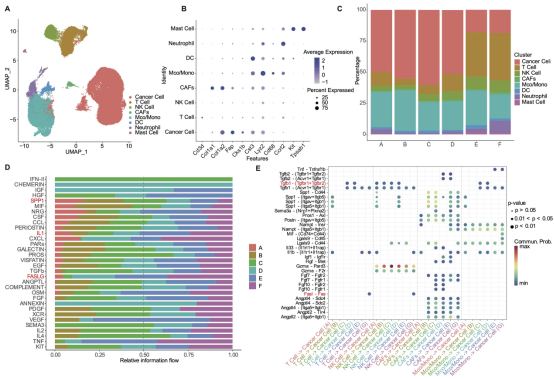
图4 . CT26-FAP荷瘤小鼠中细胞类型和细胞信号通路的鉴定。(A)所有细胞的UMAP图。(B)显示了不同细胞成分的特征标记基因。(C)柱状图显示了不同组别的主要细胞的比例。(D)柱状图显示了不同组别中不同细胞信号通路的比例。(E)突出显示了T细胞、NK细胞、CAFs、Mco/Mono和肿瘤细胞之间的配体-受体相互作用。
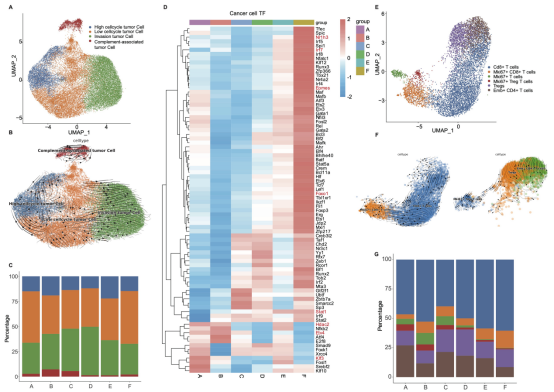
图5 CT26-FAP荷瘤小鼠中肿瘤细胞和T细胞的特征分析。(A) 肿瘤细胞的UMAP图。(B)RNA轨迹分析反映了肿瘤细胞的进化过程。(C)柱状图显示了肿瘤细胞各亚群的比例。(D)SCENIC分析描绘转录因子的AUC值差异。(E)CT26-FAP荷瘤小鼠中T细胞亚群的UMAP图。(F)RNA轨迹分析反映了T细胞的进化过程。(G)柱状图显示了每组中各T细胞亚群的比例。
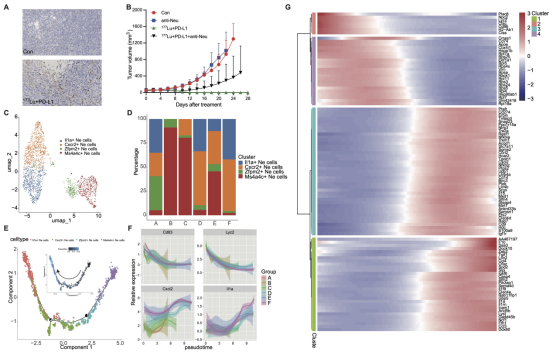
图6 肿瘤内的成熟中性粒细胞发挥协同抗肿瘤效应及其机制。(A)CT26-FAP荷瘤小鼠肿瘤样本中Ly6G的免疫组化染色。(B)阻断中性粒细胞后CT26-FAP荷瘤小鼠的肿瘤生长曲线。(C)中性粒细胞簇的UMAP图。(D)柱状图显示了中性粒细胞各亚群分布的比例。(E) Monocle2拟时序分析揭示中性粒细胞亚簇内的演变趋势。(F)中性粒细胞在不同细胞阶段关键基因表达水平的轨迹变化。(G)整个拟时序内中性粒细胞中差异表达最显著的基因热图。
通讯作者简介

陈皓鋆,厦门大学附属第一医院核医学科&闽南PET中心副主任、科研处副主任、厦门大学临床医学研究院副院长。教授,副主任医师,博士生导师;国家优秀青年科学基金获得者。担任核医学顶刊J Nucl Med编委、 Eur J Nucl Med Mol Imaging编委、《中华核医学与分子影像杂志》编委;主持国家自然科学基金3项,并主持福建省杰出青年科学基金、福建省卫健委重大项目。荣获中华医学会核医学分会“希望之星”、北美核医学与分子影像学会“青年科学家”奖(SNMMI Ones to Watch,全球30名)。以第一/通讯作者在J Clin Invest、Clin Cancer Res、Radiology等行业顶刊发表SCI论文40余篇;以第一发明人获国家发明专利3项、美国发明专利1项;获福建省科技进步三等奖(第一完成人)、厦门市科技进步二等奖(第一完成人)、上海市医学科技二等奖(第二完成人)。

赵亮,厦门大学附属第一医院核医学科&闽南PET中心主治医师。厦门大学与新加坡国立大学联合培养博士,以第一/通讯作者在J Clin Invest、Radiology、J Nucl Med(6篇)、Eur J Nucl Med Mol Imaging(7篇)、Signal Transduction and Targeted Therapy、Theranostics等国际权威期刊发表论著29篇(5篇入选ESI高被引论文)、个案报道8篇,H影响因子23,累计被引超过2200次。连续入选2022、2023全球“前2%顶尖科学家”榜单(world’s top 2% scientists),获得2023、2024年北美核医学与分子影像学会Alavi-Mandell奖,2024年北美核医学与分子影像年会国际最佳摘要和旅行奖,并以主要完成人获厦门市科技进步二等奖、福建省科技进步三等奖、福建省抗癌协会科技进步奖二等奖。

陈小元,于1993年和1996年分别获得南京大学化学学士和硕士学位,随后1999年获得美国爱达荷大学博士学位。经过Syracuse大学和Washington大学圣路易分校博士后训练,于2002年进入南加州大学放射学系任助理教授,2004年转入斯坦福大学,2008年升为副教授。2009年加入美国国立卫生研究院(NIH)生物医学影像及医学工程所(NIBIB)任资深研究员,分子影像及纳米医学实验室(LOMIN)主任。2020年入职新加坡国立大学医学院和工程学院任终身Nasrat Muzayyin讲席教授。2012年获NIBIB Mentor Award, 2014年获NIH Director’s Award, 2016年获ACS Bioconjugate Chemistry Lecturer Award,2017年当选AIMBE Fellow, 2019年获得SNMMI Michael J. Welch Award,2020年当选SNMMI Fellow,2024年当选欧洲科学院院士,新加坡科学院院士。陈小元教授的科研方向主要涉及体外诊断,体内成像,基因/药物的纳米载体,以及诊疗一体化。已发表900多篇SCI论文(H影响因子172,引用率超过11万次)。陈小元教授是Acc Chem Res, ACS Nano等多家杂志的编委,Theranostics杂志的创刊主编(2022年影响因子12.4),中美核医学及分子影像学会(CASNMMI),中美纳米医学及纳米生物技术学会(CASNN),以及美国核医学及分子影像学会(SNMMI) Radiopharmaceutical Science Council (RPSC)前任主委。

苏国强,教授,主任医师,博士生导师,厦门大学附属第一医院结直肠肿瘤外科科主任。厦门市重点引进人才,省中青年骨干教师。先后在日本国立癌症中心、瑞典隆德大学访问学习。在胃、结直肠肿瘤腹腔镜微创治疗方面拥有深厚的专业背景,主持国家自然科研基金课题2项,省市级科研课题10余项,获省厅级科技进步二等奖4项(第1完成人),发表科研论文70余篇, SCI收录20余篇,专利7项。
第一作者简介

陈健豪,厦门大学2023级肿瘤学博士研究生,导师为厦门大学附属第一医院苏国强和陈皓鋆教授,硕博在读期间以第一作者/共同第一作者在Signal Transduction and Targeted Therapy、Eur J Nucl Med Mol Imaging 、Theranostics、JITC等期刊发表SCI论文6篇。曾获硕士及博士研究生国家奖学金、厦门大学潘懋元一等奖学金。
周扬帆
,
厦门大学2022级生理学博士研究生,导师为厦门大学附属第一医院林勤
和陈皓鋆
教授,研究方向为肿瘤精准放射治疗及免疫治疗。以第一作者/共同第一作者
在
Signal Transduction and Targeted Therapy
、JITC、Front Genet 等期刊发表
SCI
论文4 篇。

逄一臻,厦门大学2021级肿瘤学博士研究生,导师为厦门大学附属第一医院林勤教授和陈皓鋆教授,硕博在读期间以第一作者/共同第一作者在Radiology、J Nucl Med、Eur J Nucl Med Mol Imaging、Signal Transduction and Targeted Therapy等国际权威期刊发表研究论文多篇。曾获硕士及博士研究生国家奖学金、厦门大学三大奖本栋奖学金,获得2021欧洲核医学会(EANM)“年度最佳论文奖”、2024年北美核医学协会Alavi-Mandell奖,以共同完成人身份获厦门市科技进步二等奖、福建省抗癌协会科技进步奖二等奖。