近期,厦门大学附属第一医院核医学科团队及新加坡国立大学杨潞龄医学院/工程学院团队在肿瘤学顶级期刊《Clinical Cancer Research》(中科院一区,IF=10.4)正式发表了题为“177Lu-LNC1004 Radioligand Therapy in Patients with End-Stage Metastatic Cancers: A Single-Center, Single-Arm, Phase II Study”的临床研究。该研究在前期177Lu-LNC1004安全性及剂量学的研究基础上,进一步验证其在多线治疗失败的晚期实体瘤患者中的临床疗效。厦门大学附属第一医院核医学科&闽南PET中心付浩博士、黄劲雄教授、赵亮博士为该论文的共同第一作者;厦门大学附属第一医院核医学科&闽南PET中心陈皓鋆教授,新加坡国立大学杨潞龄医学院/工程学院陈小元教授、张静静教授为该项工作的共同通讯作者。
背景介绍
癌相关成纤维细胞(CAF)是肿瘤微环境(TME)中最常见的基质细胞,在肿瘤组织构成中占很大一部分。成纤维细胞激活蛋白(FAP)在超过90%的上皮组织来源的肿瘤中表达。FAP阳性的CAF通过影响细胞外基质重塑、细胞内信号传导、血管生成、上皮间质转化和免疫调控促进肿瘤的发展和转移。因FAP在正常组织中的表达极低,已成为泛肿瘤靶点。
虽然多种治疗策略在改善肿瘤患者预后方面取得了显著进展,但仍存在一些挑战,特别是当肿瘤发生治疗抵抗时,易引起复发、转移,最终导致肿瘤患者死亡。因此,针对转移性肿瘤治疗迫切需要有效的新方法。TME中CAF和细胞外基质是肿瘤治疗抵抗的重要因素,靶向FAP的放射配体疗法(RLT)通过“交叉火力”效应同时靶向FAP阳性的CAF和邻近的肿瘤细胞及TME内基质细胞。目前,多种靶向FAP的放射性配体,包括FAP抑制剂(FAPIs)和FAP结合肽,已被开发用于肿瘤显像和治疗。不过,相对较短的瘤内滞留时间,限制了其治疗潜力,尤其是当利用长半衰期放射性核素如镥-177(177Lu)和钇-90 (90Y)标记进行治疗时,该限制尤为明显。
血浆中白蛋白含量丰富,可与生物活性药物可逆性结合,使白蛋白-药物复合物作为储存库,从而增强药物分布和生物利用度,因此其已成为一种多功能的药物载体。伊文思蓝(EB)作为很有前景的白蛋白结合基团,与白蛋白结合位点1具有较高的亲和力,当EB与药物结合后可延长药物半衰期,从而提升疗效。我们前序在转移性碘难治性甲状腺癌患者的I期研究中证实了177Lu-EB-FAPI(177Lu-LNC1004)作为与EB结合的靶向FAP的放射性药物,在3.33GBq/周期的剂量下展现出显著的疗效和可接受的副作用。上述初步结果促使我们进一步探究177Lu-LNC1004在治疗其他实体瘤方面的潜力。因此,本研究将探索固定剂量(3.33 GBq/周期)的177Lu-LNC1004在终末期转移性肿瘤患者中的初步临床治疗经验,并评估177Lu-LNC1004在标准治疗方案失败后的多种实体瘤患者中的疗效和安全性。
研究方案
所有患者入组前均接受68Ga-FAPI-46 PET/CT筛查评估,以确认肿瘤FAP高表达。纳入标准:(1)年龄大于18岁的进展性转移瘤患者;(2)肿瘤不可切除;(3)多学科肿瘤委员会确定的所有获批疗法均无效;(4)68Ga-FAPI-46 PET/CT显像提示肿瘤中的FAP靶点呈高度表达。排除标准:(1)血肌酐水平>150 μmol/L;(2)血红蛋白水平<8.0g/dL;(3)白细胞计数<2.0×109/L;(4)血小板计数<50×109/L;(5)总胆红素水平为正常上限值的3倍,血清白蛋白水平为2.0 g/dL;(6)心功能不全,包括类癌性心脏瓣膜疾病、严重过敏或对X线造影剂过敏;(7)幽闭恐怖症;(8)妊娠或哺乳期。
在177Lu-LNC1004治疗当日,无需特殊准备,无需限制饮食。患者治疗前服用4 mg昂丹司琼以预防恶心、呕吐。将177Lu-LNC1004混入100mL的0.9%生理盐水中缓慢静脉滴注20-30min。在治疗过程中密切监测患者症状及生命体征。治疗方案为4个周期,每周期间隔6周。如患者出现3级以上(包括3级)不良事件(AE)并持续4周未缓解,或疾病进展使患者无法耐受进一步治疗,则治疗终止。所有患者在治疗前及治疗后的每2周进行一次随访,包括血常规及肝肾功能评估。如出现AE,则每周复查直至缓解。分析患者的血液、胃肠、肾脏、肝脏及其他不良事件,并根据不良事件通用术语标准(CTCAE)5.0版进行分级。所有导致治疗延迟或终止的事件均记录。研究人员评估AE与疾病进展或治疗之间的相关性。
根据实体瘤疗效评价标准(RECIST) 1.1版,采用68Ga-FAPI-46 PET/CT和增强CT/MRI进行抗肿瘤疗效评估。每个治疗周期后6周进行68Ga-FAPI-46 PET/CT检查,每12周进行增强CT/MRI检查。主要研究终点为177Lu-LNC1004治疗后的抗肿瘤疗效,包括客观缓解率(ORR)及疾病控制率(DCR) (基于治疗后的RECIST疗效评价标准)。根据实体瘤RECIST 1.1标准,治疗后的临床疗效评价指标包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。最佳RECIST客观反应为基线到治疗中的任一时间点(包括治疗后再分期)之间观察到的最佳反应(best response)。次要终点为无进展生存期(PFS)和总生存期(OS)。PFS是从治疗开始,直至疾病进展(PD)、死亡或末次随访(2024年08月底)中的任意事件为止。OS是从治疗开始,直至死亡或末次随访为止。不良反应(AE)监测、肿瘤剂量学评估也作为其他次要研究终点。
结果
2022年06月至2024年04月期间共筛选了50名患者,其中9名患者FAP表达不符合入组要求,13名患者因筛选期间疾病迅速恶化、治疗决策改变或其他原因未接受177Lu-LNC1004治疗。最终,28名患者(56%)共接受了63个周期的放射配体治疗。所有患者均接受了至少1周期的治疗,在研究结果分析时,仍有1例患者在治疗中。28例患者中,19例(68%)、10例(36%)、6例(21%)患者分别接受了2周期、3周期及4周期治疗。治疗终止原因包括肿瘤进展(4/28,14%)、疾病迅速恶化(10/28,36%)、血小板降低(4/28,14%)、治疗决策改变(3/28,11%)(图1)。28例患者中,54%的患者为女性,45%的患者为转移性碘难治性甲状腺癌。其他肿瘤类型包括乳腺癌(10%)、神经内分泌癌(7%)、肉瘤(7%)、非小细胞肺癌(7%)、胃癌(4%)、结肠癌(4%)、鼻咽癌(4%)、肾癌(4%)、食管癌(4%)、前列腺神经内分泌癌(4%)。患者均为晚期肿瘤累及多器官,淋巴结、肺和骨为最常见转移部位。患者在177Lu-LNC1004 治疗前平均接受过两种系统治疗方案,并在末次治疗方案中出现疾病进展。28例患者中,24例(86%)患者的东部肿瘤合作组织(ECOG)状态评分≥ 2,其中8例患者为无法耐受化疗/接近卧床的晚期癌症患者(ECOG=4)。177Lu-LNC1004治疗的中位累积剂量为7.0 GBq,单次治疗接受的中位剂量为3.1 GBq/周期,治疗持续中位时间为3个月。

图1. 177Lu-LNC1004治疗患者流程图。
177Lu-LNC1004在给药后1h内主要分布在血池。给药后4h可见肿瘤摄取177Lu-LNC1004。SPECT/PET显示,177Lu-LNC1004在给药4h后的体内分布与68Ga-FAPI-46注射后1h的体内分布一致。治疗后第1、2、3、4、7天连续全身扫描及SPECT/CT显示肿瘤显著摄取177Lu-LNC1004。治疗后2周延迟扫描显示肿瘤仍有显著摄取,提示药物在肿瘤内滞留时间显著延长(图2A-B)。28例患者中有25例(89%)进行了剂量学分析,肿瘤病灶的平均吸收剂量为4.69±3.83 Gy/GBq。其中,骨、淋巴结、肺和其他部位转移灶的平均吸收剂量分别为4.57±1.98 Gy/GBq、4.88±4.39 Gy/GBq、6.47±6.75 Gy/GBq及 3.77±1.74 Gy/GBq(图2C)。
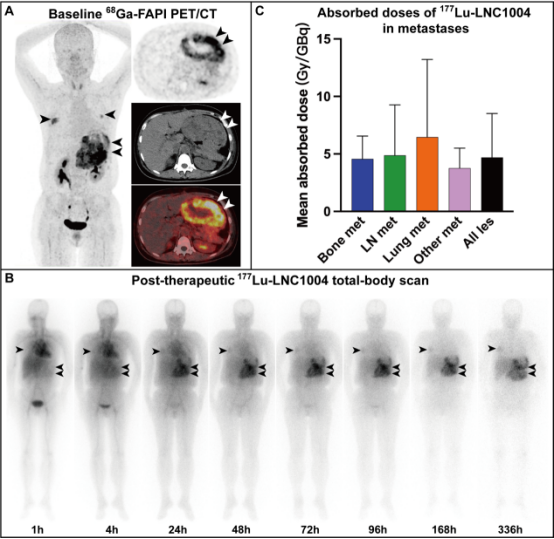
图2. 一例54岁女性患者,因转移性平滑肌肉瘤接受了两次手术、化疗、酪氨酸激酶抑制剂和PD-1治疗,但仍出现疾病进展。177Lu-LNC004治疗前进行68Ga-FAPI-46 PET/CT 显像,提示腹膜转移灶及肺转移灶显著摄取68Ga-FAPI-46(A,上:PET;中:CT;下:融合图,箭头所示为病灶)。患者接受了3.33 GBq的177Lu-LNC1004治疗,治疗后1-336h全身扫描(前位)显示,转移灶显著摄取177Lu-LNC1004(箭头所示),与68Ga-FAPI-46 PET/CT显像结果一致(B)。177Lu-LNC1004的肿瘤平均吸收剂量(C)。
患者总体对177Lu-LNC1004治疗耐受性良好,治疗期间未出现即时不良反应及治疗相关的死亡事件。血液毒性是治疗期间最常见的AE,主要包括贫血、血小板降低及白细胞降低。在所有记录的AE中(121条),88条(73%)是基于实验室检查,33条(27%)是基于临床症状。28例患者中,19例(68%)患者发生了3/4级AE。12例患者(43%)发生了3/4级血液相关AE,包括贫血(6/28,21%)、血小板降低(8/28,29%)、白细胞降低(2/28,7%)及中性粒细胞降低(2/28,7%)。13例患者(46%)发生了3/4级的一般症状,包括吞咽困难(3/28,11%)、肿瘤痛(11/28,39%)及呼吸困难(1/28,4%),无患者发生3/4级肝毒性及肾毒性AE。一名男性患者在一个治疗周期后出现3级血小板降低,导致治疗终止,在干预治疗4周后血小板计数恢复正常。另一名多发骨转移的男性患者经过一个治疗周期后出现3级血小板降低,并在干预治疗3周后恢复,患者随后改为其他治疗方案。一名多发骨转移的女性患者在两个治疗周期后出现4级血小板降低,导致治疗终止,患者血小板计数在4周的干预治疗后恢复正常。另一名男性患者在2个治疗周期后也观察到3级血小板降低。然而,这名患者在治疗血液AE的过程中因感染新型冠状病毒导致呼吸衰竭而死亡。此外,3级白细胞降低及中性粒细胞降低分别在一名男性(3次治疗后)及一名女性患者(2次治疗后)中发生。其不良反应在干预治疗2周后恢复,在后续治疗中没有再发生。该女性患者虽然干预治疗后白细胞及中性粒细胞数恢复正常,但因疾病进展而终止治疗。治疗期间也在2例(7%)骨转移患者中发生了177Lu-LNC1004治疗相关的3级骨痛,症状分别出现在治疗后的第1天和第5天,持续约2天,在患者使用非甾体类抗炎药和羟可酮后症状有所改善。
28例患者中,8例(29%)未进行治疗后的RECIST疗效评估,其中7例患者在未达到治疗后RECIST评估时间节点时就已因疾病进展而死亡,1例患者在进行结果分析时未达到评估节点。在剩余20例患者中,4例(20%)达到PR,9例(45%)显示SD(图3),客观缓解率(ORR)为20%,DCR为65%。图4为177Lu-LNC1004治疗的典型病例。在28例患者中,5例(18%)患者在第一次影像评估时间点前(治疗后12周)就已死亡,因此未达到最佳RECIST客观反应。在其余23例患者中,6例(26%)达到PR,13例(57%)显示SD。值得注意的是,PR、SD、PD三组患者的靶病灶在治疗后的68Ga-FAPI-46中摄取值较治疗前显著降低。但SUVmax变化百分比与RECIST疗效之间无显著相关性(P=0.352)。
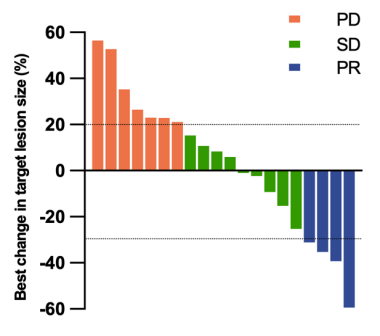
图3. 靶病灶最大直径和与基线时的最佳变化(n=20)。
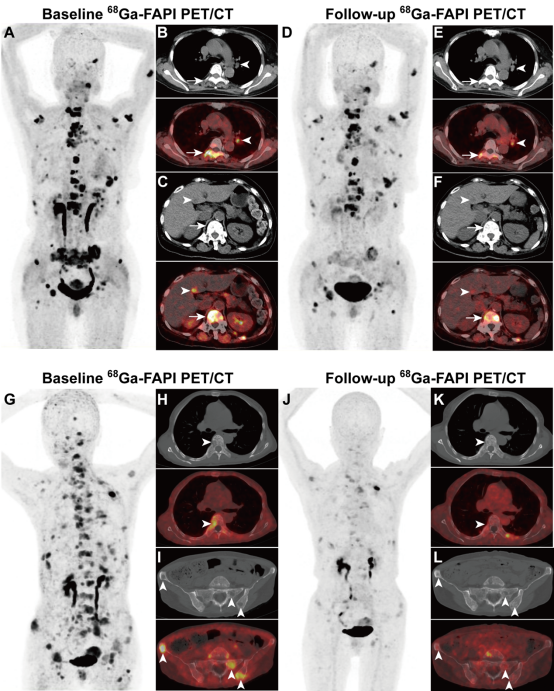
图4. 一名60岁女性患者10年前因乳腺癌接受了手术、化疗和内分泌治疗,6年前因肿瘤转移,骨转移灶接受了手术和外放疗。尽管患者后续接受了CDK4/6抑制剂和选择性雌激素受体降解剂治疗,但疾病仍进展。基线68Ga-FAPI-46 PET/CT显示转移灶(A)显著摄取68Ga-FAPI-46,其中包括纵隔淋巴结(B,上:CT;下:融合图;箭头所示)、胸椎和肝转移(C,上:CT;下:融合图;箭头所示)。经2个周期的177Lu-LNC1004治疗后,68Ga-FAPI-46 PET/CT提示大部分转移灶(D、E、F)的放射性摄取明显降低,根据RECIST 1.1评估为疾病稳定。1例55岁女性甲状腺髓样癌广泛骨转移的患者经酪氨酸激酶抑制剂治疗后出现疾病进展,接受了177Lu-LNC1004治疗。基线PET/CT提示骨转移灶显著摄取68Ga-FAPI-46(G),病灶主要表现为溶骨性骨质破坏,并伴软组织肿块形成(H和I,上,CT;下:融合,箭头所示)。治疗后68Ga-FAPI-46 PET/CT显示,经2个周期177Lu-LNC1004治疗后,上述转移灶(J、K、L)的肿瘤体积明显缩小,放射性摄取明显降低,根据RECIST 1.1标准评估为部分缓解。
临床病理学特征与RECIST客观反映间单因素分析显示,DCR组和非DCR组在性别、年龄、ECOG状态评分、初诊时间、既往治疗方案数、受累器官数及骨转移方面无显著差异。即便下列参数没有统计学差异,但接受177Lu-LNC1004治疗次数>2、治疗前基线血红蛋白水平>117 g/L、治疗前基线白细胞计数≤10×109/L、治疗前基线血小板计数≤239×109/的组别显示更好的DCR。值得注意的是,在可进行治疗后RECIST评估的患者(65.0%)中,靶病灶平均SUVmax≤15的组别相较于靶病灶平均SUVmax>15的组别有更好的DCR(P=0.022)。多因素分析显示,靶病灶平均SUVmax是DCR的独立影响因素(P=0.021)。
28例患者的中位随访时间为18.1个月(0.9-24.6个月)。28例患者中,16例(57%)患者从治疗开始随访时间超过了6个月。中位PFS为4.0个月(95%置信区间[CI]:0.8-7.2)(图5A)。随访期间,28例患者中有19例(68%)死亡,中位OS为6.3个月(95%CI:0.8-11.7)(图5B)。根据RECIST客观反应分类进行分层分析,达到疾病控制患者(PR和SD)的中位PFS为16.3个月,显著长于疾病进展的患者(1.9个月)和无法评估的患者(1.7个月)(P<0.001)(图5C)。同样地,达到疾病控制(PR和SD)患者的中位OS为18.4个月,显著长于疾病进展的患者(6.1个月)和无法评估的患者(1.7个月)(P<0.001)(图5D)。以上结果表明FAP放射配体疗法治疗结束后的疗效反应评估与患者的预后均具有相关性。
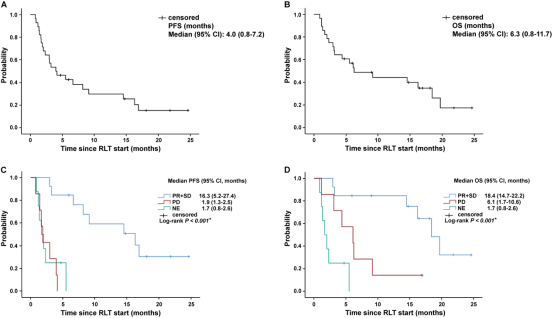
图5. RLT启动后28例患者的生存结果。根据177Lu-LNC1004 RLT后的主要终点RECIST客观反应分层后(C和D)不同组别的PFS和OS。NE:无法评估;NR:未达到;PD:疾病进展。
单因素分析显示性别、初诊时间、既往局部治疗线数或基线血小板计数对PFS或OS无明显影响。同样,有骨转移和无骨转移的患者的PFS和OS无统计学差异。然而,PFS和OS与年龄(P = 0.041和0.005)和患者ECOG评分(P = 0.026和0.009)显著相关。在177Lu-LNC1004之前接受过≤2种系统治疗方案的患者PFS和OS显著长于既往接受过>2种系统治疗方案的患者(P = 0.014和0.006)。此外,与另外一些患者相比,基线白细胞计数为≤10×109/L的患者具有更长的PFS和OS(P < 0.001和0.004),血红蛋白水平>117g/L的患者具有更长的PFS (P = 0.028),但OS差异无统计学意义(P = 0.113)。肿瘤累及≤3个器官的患者OS更长(P = 0.015),但PFS差异无统计学意义(P = 0.195)。靶病灶平均SUVmax≤15的患者也有更长的PFS (P = 0.038),但OS差异无统计学意义(P > 0.05)。值得注意的是,接受>2个周期177Lu-LNC1004治疗的患者比接受≤2个周期的患者有更好的预后(中位PFS,16.3个月vs. 2.0个月,P < 0.001;中位OS,18.4个月vs. 3.1个月,P = 0.010)。
多因素分析显示,既往接受过≤2种系统治疗方案、≤3个脏器转移、基线血红蛋白>117g/L和基线白细胞计数≤10×109/L是更长的PFS (P = 0.005、0.003、0.004和0.001)和OS(P = 0.002、0.002、0.019和0.005)的独立预后因素(图6)。靶病灶平均SUVmax ≤15和接受>2周期177Lu-LNC1004治疗为较长PFS的独立预后因素(P = 0.004和0.033)。性别、年龄和ECOG评分均不是PFS或OS的独立预后因素(P > 0.05)。
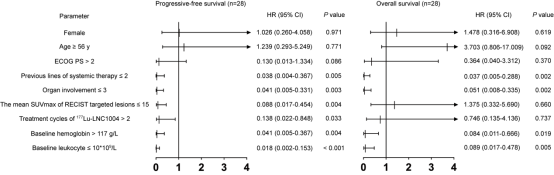
图6. Cox比例风险模型对177Lu-LNC1004治疗患者的无进展生存期和总生存期潜在预后因素进行多因素分析。箭头表示该值不在显示范围内。
小结
对于多种晚期癌症,3.33 GBq/周期的177Lu-LNC1004放射配体疗法不仅显示出一定的抗肿瘤治疗效果,还在延长患者生存期方面具有重要意义。此项研究不仅填补了部分晚期癌症治疗领域的空白,还为未来FAP靶向放射性配体的临床适应症奠定了基础。值得注意的是,该研究入组的所有患者均为临床多线治疗失败后的晚期转移性肿瘤患者,其中86%患者的ECOG评分≥2分,而177Lu-LNC1004的DCR依旧达到了65%。未来仍需在更大样本、更多类型的肿瘤患者中进行前瞻性临床试验以评估这种新型放射配体疗法的临床价值。
主要作者介绍
通讯作者

陈皓鋆,厦门大学附属第一医院核医学科PET中心副主任、科研处副主任、临床医学研究院副院长;国家优秀青年科学基金获得者。目前担任中国医师协会核医学分会青年学组副组长、福建省第十三届青年联合会常委。研究方向为核医学显像及治疗的临床转化,尤其是针对SSTR2、FAP、PSMA等肿瘤关键靶点放射配体治疗的临床研究。担任核医学权威期刊J Nucl Med编委、Eur J Nucl Med Mol Imaging编委、《中华核医学与分子影像杂志》编委;目前主持国家自然科学基金项目3项,并作为主要研究者(leading PI)牵头核素显像/治疗类临床研究10余项。2022年获北美核医学与分子影像学会“青年科学家”奖(SNMMI Ones to Watch,全球30名)。
第一作者

付浩,厦门大学附属第一医院核医学科主治医师,福建省“海纳百川”高层次人才,厦门市高层次人才,中国医药教育协会核医学专业委员会委员,福建省海峡肿瘤防治科技交流协会委员,毕业于上海交通大学医学院,先后师从核医学领域著名专家吴华教授,甲状腺癌诊疗领域著名专家陈立波教授。主攻碘难治性甲状腺癌分化治疗、碘难治性甲状腺癌靶向治疗、甲状腺癌放射性核素诊疗一体化,肿瘤放射性核素诊疗一体化。2022年获批福建省自然科学基金青创项目、2021年获批国家自然科学基金青年项目,2020年获批厦门市医疗卫生指导项目,参与多项国家自然科学基金面上项目。研究结果入选2023、2024年SNMMI YIA,入选2022-2023年SNMMI及EANM口头汇报。以第一作者身份在《Clinical Cancer Research》、《Radiology》、《Endocrine-Related Cancer》、《Clinical Nuclear Medicine》、《Molecular Therapy Oncolytics》等多个杂志发表SCI论文16篇

黄劲雄,厦门大学附属第一医院核医学科主任、教授、硕士生导师。担任中华医学会核医学分会功能显像学组委员、中华医学会核医学分会治疗学组第一届放射性粒子介入工作委员会委员、中华医学会核医学分会心脏学组委员、美国核心脏病学会(ASNC)国际会员、中国抗癌协会肿瘤核医学专业委员会委员、中国抗癌协会肿瘤核医学专业委员会第一届治疗学组委员、全国高等学校八年制核医学配套教材编委、中国医药质量管理协会医学影像质量研究委员会核医学专业委员会委员、福建省医师协会核医学医师分会常委、福建省核医学质控中心委员、福建省医学会核医学分会委员、厦门市环境应急专家库成员、厦门市医学会第四届医疗事故暨医疗损害技术鉴定专家库成员、厦门市核学会理事。从事核医学临床工作20余年,擅长放射性核素治疗、SPECT/CT影像诊断,尤其对甲状腺癌诊治方面有独到的见解。主持及参与国家、福建省及厦门市科学基金数项,发表SCI及中华核心期刊10余篇。

赵亮,厦门大学附属第一医院核医学科&闽南PET中心主治医师。厦门大学与新加坡国立大学联合培养博士,以第一/通讯作者在J Clin Invest、Radiology、J Nucl Med(6篇)、Eur J Nucl Med Mol Imaging(7篇)、Signal Transduction and Targeted Therapy、Theranostics等国际权威期刊发表论著31篇(5篇入选ESI高被引论文)、个案报道8篇,H影响因子25,论文累计被引超过2400次。连续入选2022、2023全球“前2%顶尖科学家”榜单(world’s top 2% scientists),获得2023、2024年北美核医学与分子影像学会Alavi-Mandell奖,2024年北美核医学与分子影像年会国际最佳摘要和旅行奖,并以主要完成人获厦门市科技进步二等奖、福建省科技进步三等奖、福建省抗癌协会科技进步奖二等奖。