近期,我院康复医学科倪国新教授团队在《Journal of Advanced Research》期刊上发表题目为:“Antioxidant taurine inhibits chondrocyte ferroptosis through upregulation of OGT/Gpx4 signaling in osteoarthritis induced by anterior cruciate ligament transection”的文章。该文章探究了牛磺酸通过激活OGT/Gpx4 信号抑制软骨细胞铁死亡,从而缓解OA小鼠软骨退变的作用机制,为运动损伤继发OA的预防和治疗提供了新的方向。文章的通讯作者是厦门大学附属第一医院康复医学科倪国新教授和厦门大学化学化工学院林东海教授;第一作者是倪国新教授课题组博士生周绪昌,联合培养研究生杨雅静,邓辉丽以及林东海教授课题组博士生邱旭。

研究背景
骨关节炎(Osteoarthritis, OA)是一种慢性退行性关节疾病。与其他类型的OA不同,继发于运动损伤的OA有明确的损伤事件。这种明确的 “起始点”事件为运动损伤继发OA的针对性预防和治疗提供了可能。深入探究运动损伤继发OA的潜在机制对科学有效地预防继发性OA是至关重要的。代谢组学作为生命科学研究领域的新兴研究手段,通过高通量检测和分析细胞代谢的小分子底物、中间产物和终产物,可即时反映和了解细胞生理和病理的动态变化,从而从代谢角度解释疾病发生和发展过程中的内在机制。在本研究中,我们通过使用前交叉韧带横断术(ACL transection, ACLT)构建运动损伤继发OA的大鼠动物模型。提取ACLT术后不同周龄(0w,4w,8w和12w)大鼠的原代软骨细胞进行代谢组学分析。结果发现牛磺酸可能是导致运动损伤继发OA进展的关键代谢分子。随后,使用牛磺酸处理炎性软骨细胞后进行转录组学和代谢组学发现,O-GlcNAc转移酶(OGT)依赖的O-GlcNAcylation和Gpx4依赖的铁死亡可能是介导牛磺酸对软骨细胞的炎症保护作用的潜在机制。这一研究假设通过功能验证得到证实。随后,进一步的实验表明,Gpx4 与 OGT 蛋白可能存在直接结合位点,这为 Gpx4 蛋白可能存在 O-GlcNAc糖基化修饰提供了证据。最后,我们通过动物实验证明了OGT依赖的O-GlcNAcylation和Gpx4依赖的铁死亡可能是牛磺酸保护ACL损伤小鼠软骨退化的潜在机制。综上所述,本研究阐明了牛磺酸能够通过激活OGT/Gpx4 信号抑制软骨细胞铁死亡,从而缓解OA小鼠软骨退变。该研究为运动损伤继发OA的预防和治疗提供了新的方向。
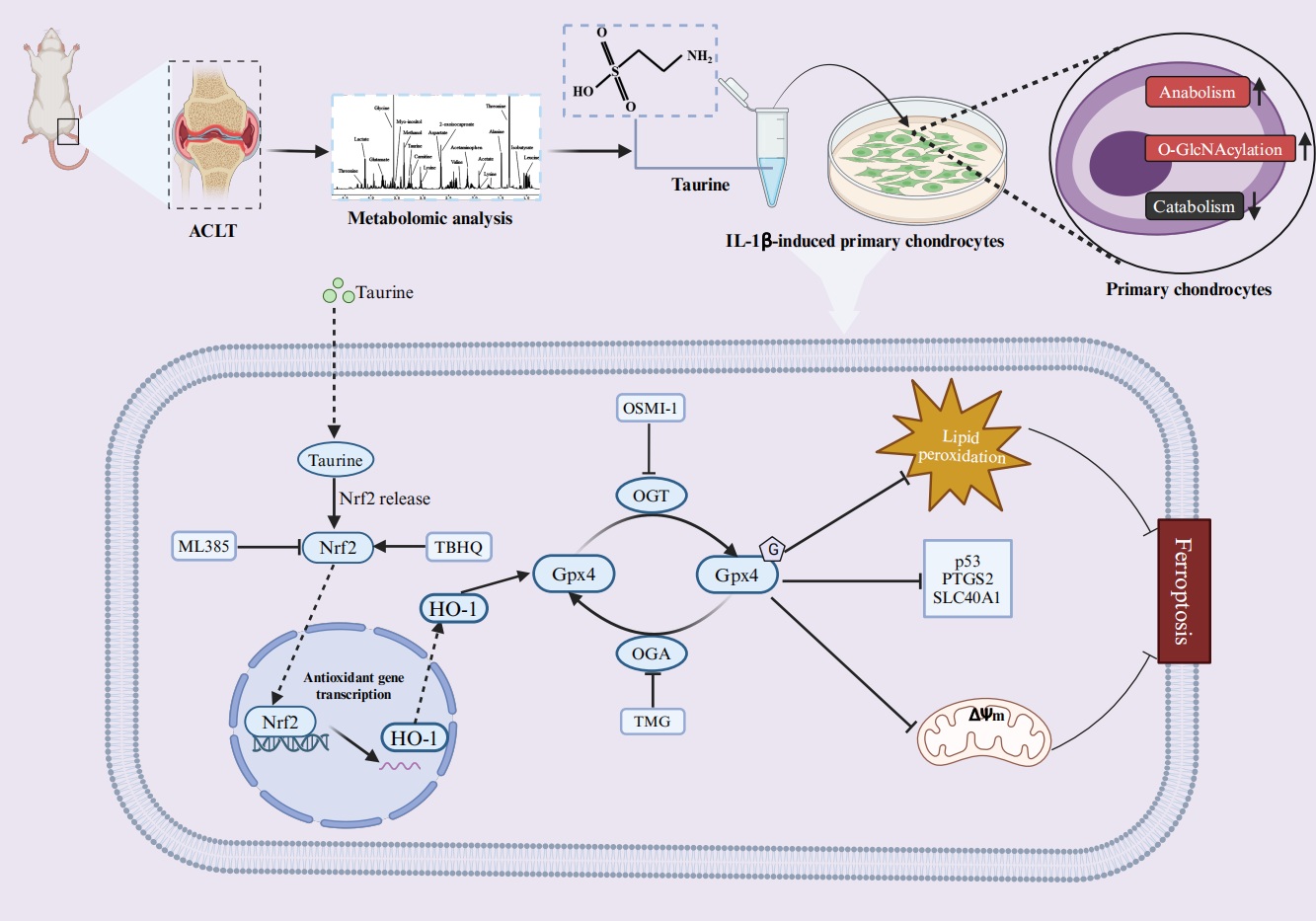
本研究分子机制示意图
研究结果
1.牛磺酸可能是运动损伤继发OA的特征性代谢产物
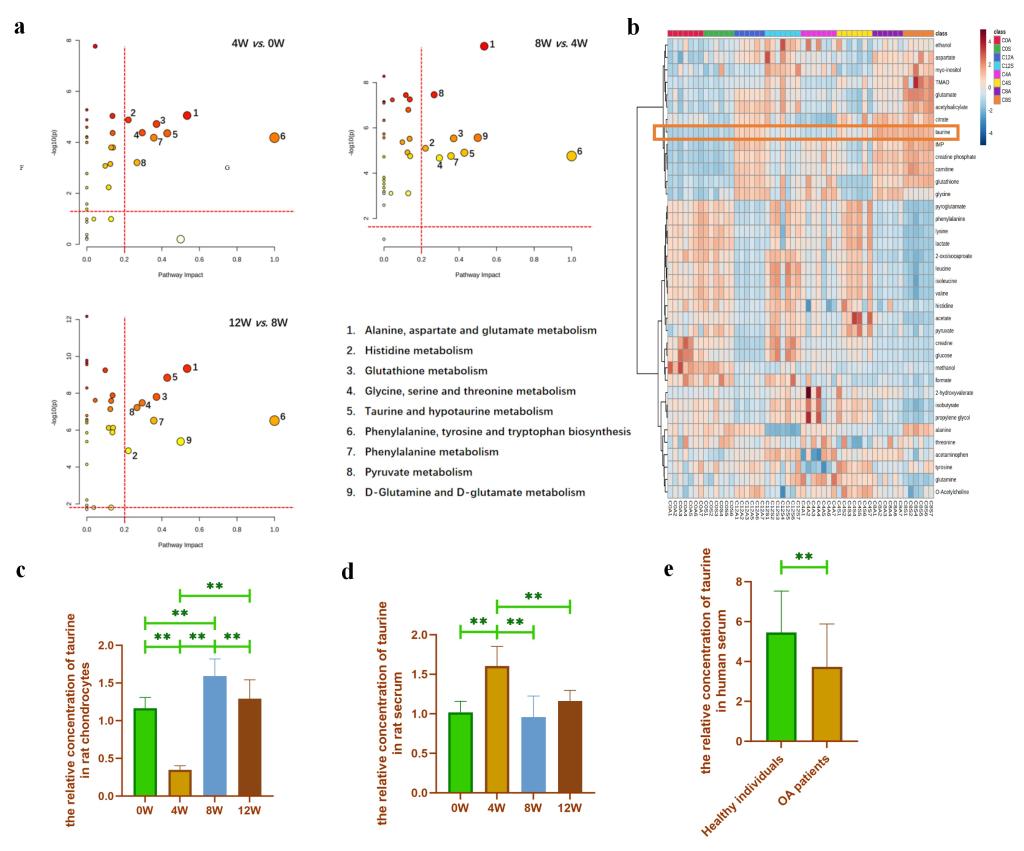
通过ACLT构建大鼠运动损伤继发OA动物模型。术后0w,4w,8w,12w,16w和20w取材使用HE染色和番红O固绿染色检测发现随着ACLT术后周龄的增加,大鼠软骨损伤逐渐加重(如图1a-e所示)。随后,我们提取ACLT术后0w,4w,8w和12w大鼠原代软骨细胞进行代谢组学检测(16w和20w大鼠由于周龄较大,细胞活性较差,无法扩增足够的细胞进行代谢组学检测)。发现牛磺酸可能是ACLT术后软骨退变过程中的特征性代谢小分子(如图2a-c所示)。此外,我们还检测了ACLT术后不同周龄大鼠血液中的牛磺酸含量以及OA患者VS非OA患者血液中的牛磺酸含量发现均存在差异表达。因此,我们猜测牛磺酸可能在OA的发生发展中发挥重要作用。
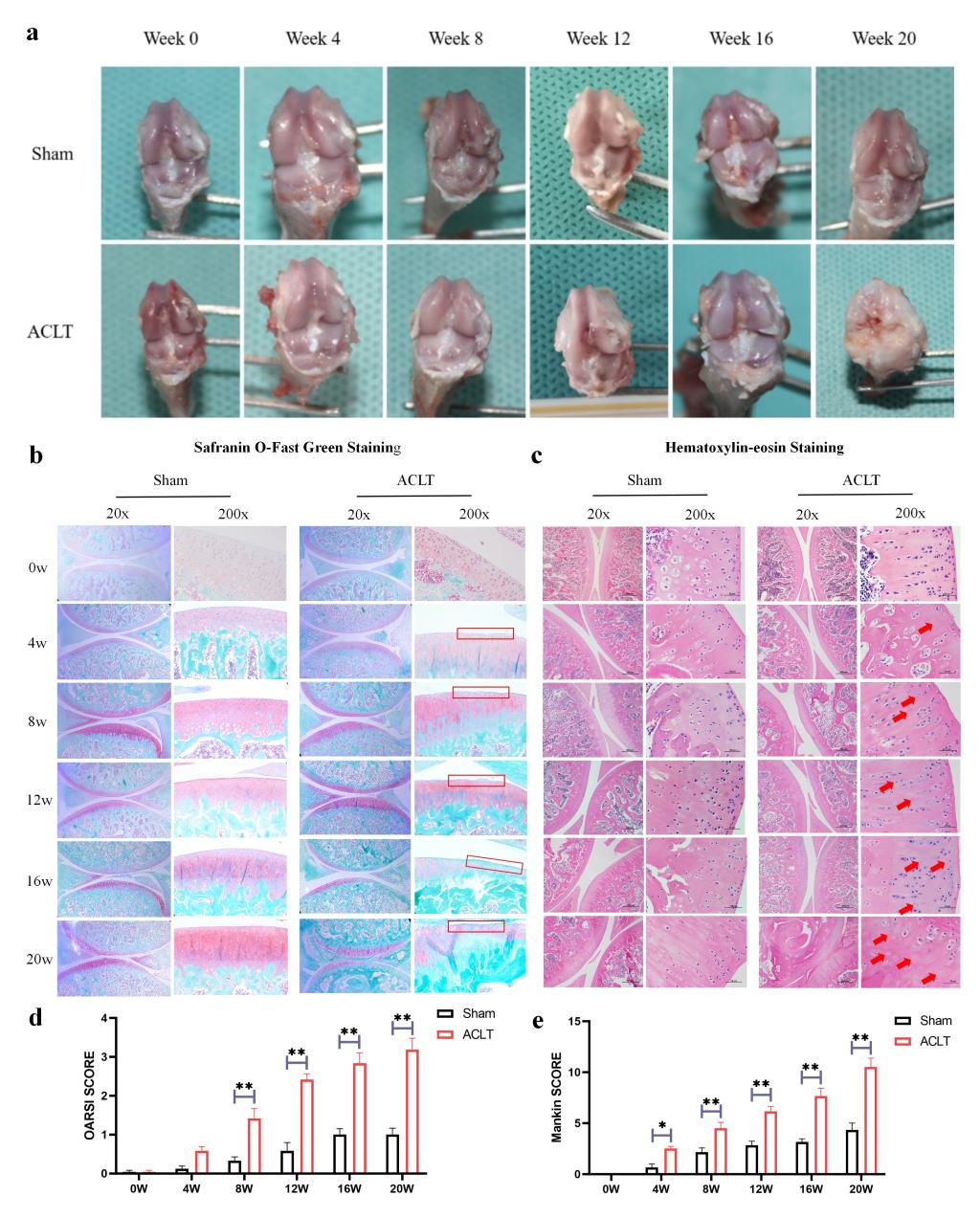
图1. 前交叉韧带撕裂术后不同时间点大鼠膝关节软骨改变。(a: 大鼠膝关节的大体观察;b: 大鼠膝关节的番红O固绿染色;c: 大鼠膝关节的HE染色;d:大鼠膝关节的OARSI评分;e:大鼠膝关节的Mankin评分。)
图2. 前交叉韧带撕裂术后不同时间点大鼠软骨细胞的代谢组学分析。(a: 软骨细胞代谢物的代谢途径分析;b:软骨细胞代谢物浓度热图;c:通过代谢组学分析ACLT组与Sham组软骨细胞牛磺酸浓度的相对比值;d:通过代谢组学分析ACLT组与Sham组之间血清牛磺酸浓度的相对比值;e:通过代谢组学分析OA患者与非OA患者血清牛磺酸浓度的相对比值。)
2.牛磺酸缓解IL-1β诱导的软骨细胞炎性损伤
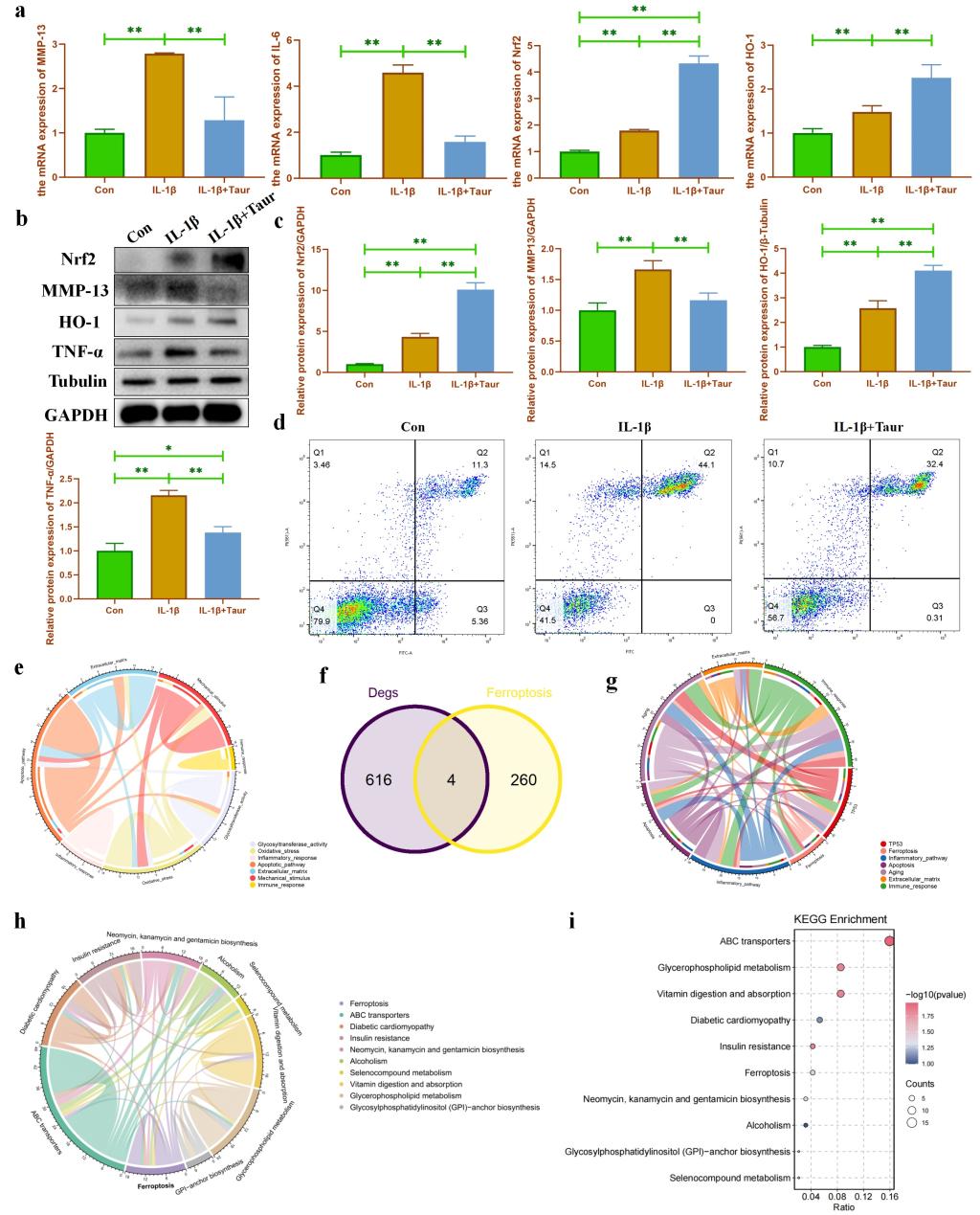
由于牛磺酸在OA软骨退变过程中呈现差异表达,我们猜测补充牛磺酸可能是减轻软骨损伤的一种潜在策略。我们首先使用IL-1β处理原代小鼠软骨细胞来构建OA体外细胞模型。我们发现牛磺酸处理能够通过重塑软骨细胞代谢来缓解IL-1β诱导的炎性损伤(图3a-c)。此外,我们还发现牛磺酸处理能够部分逆转IL-1β诱导的细胞凋亡(图3d)。随后,我们使用转录组学发现糖基化修饰和铁死亡可能是牛磺酸保护软骨细胞炎性损伤的潜在机制(图3e-f)。牛磺酸靶蛋白预测的信号通路富集分析也发现牛磺酸可能具有细胞铁死亡保护作用(图3g)。最后,我们使用代谢组学进一步确定了铁死亡和糖代谢可能是牛磺酸保护软骨细胞炎性损伤的潜在机制(图3h-i)。结合文献检索,我们提出初步的研究假设,铁死亡和O-GlcNAc糖基化修饰可能是牛磺酸保护软骨细胞炎性损伤的潜在调控机制。
图3. 牛磺酸缓解IL-1β诱导的软骨细胞炎性损伤。(a:使用qPCR检测牛磺酸对炎性软骨细胞代谢和炎症相关基因的影响;b-c:使用WB检测牛磺酸对炎性软骨细胞代谢和炎症相关蛋白的影响;d:使用流式细胞分析检测牛磺酸对IL-1β诱导的软骨细胞凋亡的影响;e:通过转录组学对牛磺酸处理组和非处理组之间差异表达基因的信号通路富集分析; f:转录组学检测到的差异基因与铁死亡基因集的交集;g:通过生物信息学分析对牛磺酸靶蛋白进行信号通路富集;h-i:通过代谢组学分析牛磺酸处理组和非处理组之间差异表达代谢物进行信号通路富集。)
3.牛磺酸通过抑制Gpx4依赖的铁死亡减轻软骨细胞炎症损伤
为了验证Gpx4依赖的铁死亡参与介导牛磺酸对软骨细胞炎性损伤的保护作用。我们首先使用WB检测发现牛磺酸能够部分逆转IL-1β诱导的软骨细胞铁死亡相关蛋白的表达(图4a)。随后,我们使用透射电镜发现牛磺酸能够改善IL-1β诱导的线粒体嵴和线粒体膜损伤(图4b)。进一步使用JC-1检测发现牛磺酸能够恢复线粒体膜电位(图4c-d)。脂质过氧化累积是细胞铁死亡的重要特征之一。我们的研究发现牛磺酸能够显著抑制软骨细胞中脂质过氧化的累积(图4e-f)。此外,我们使用亚铁离子检测试剂盒发现牛磺酸可以有效降低软骨细胞内亚铁离子浓度,从而缓解软骨细胞铁死亡(图4g)。由于Gpx4是铁死亡的关键蛋白。我们分别使用Gpx4的小分子抑制剂FIN56和shRNA来抑制Gpx4的表达,结果发现抑制Gpx4表达能够部分逆转牛磺酸对炎性软骨细胞的保护作用(图4h-j)。
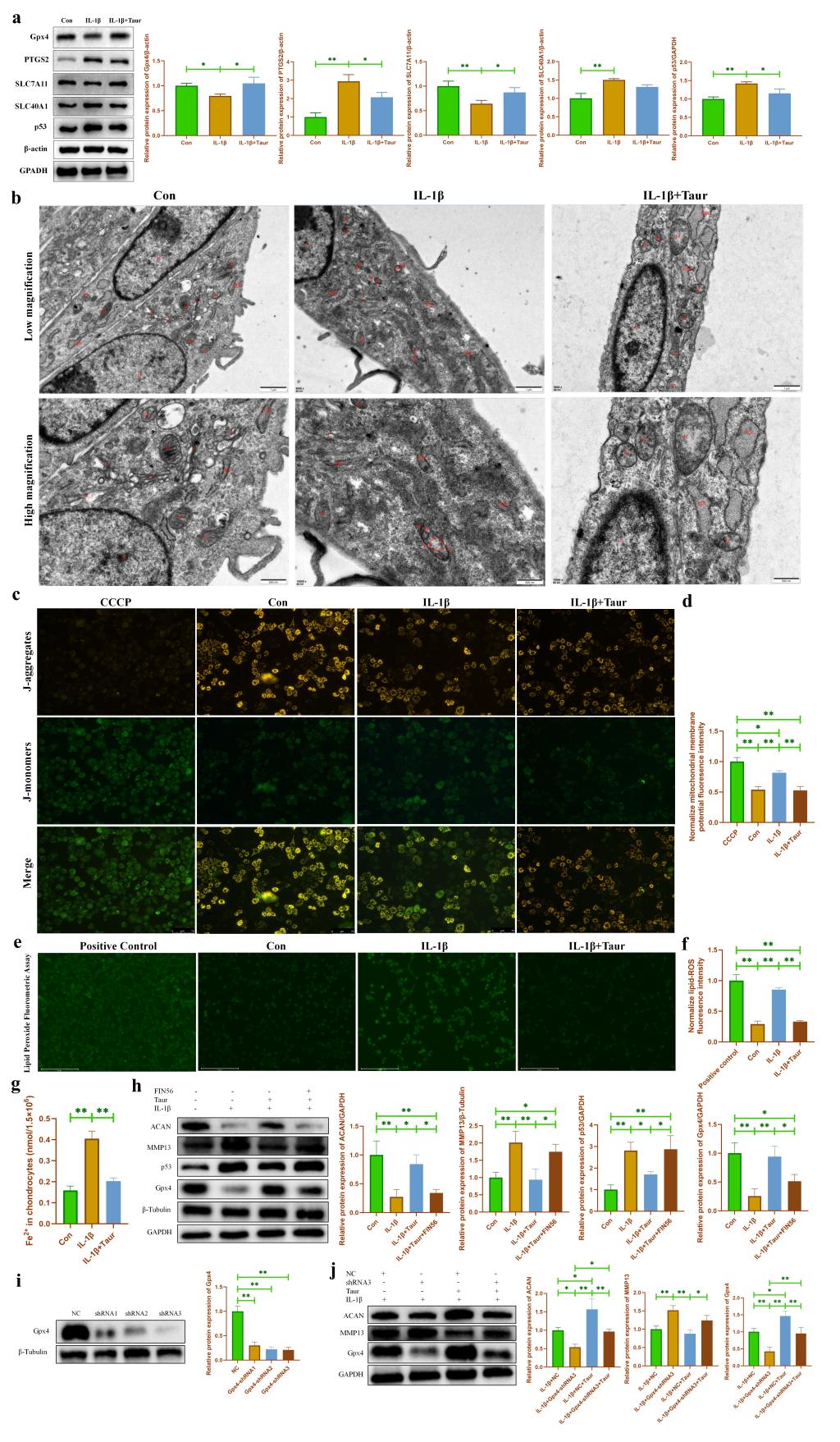
图4. 牛磺酸通过抑制 Gpx4 依赖的铁死亡保护软骨细胞炎性损伤。(a:通过 WB 检测牛磺酸处理后炎性软骨细胞中铁死亡相关蛋白表达的改变;b:通过透射电子显微镜检测牛磺酸处理后炎性软骨细胞中细胞器的改变;c-d:通过JC-1检测牛磺酸处理后 炎性软骨细胞中线粒体膜电位的改变;e-f:用过氧化脂质检测试剂盒检测牛磺酸处理后 炎性软骨细胞中脂质过氧化物的变化;g:用亚铁离子比色测定试剂盒检测牛磺酸处理后炎性软骨细胞中亚铁离子浓度的变化;h:通过WB检测Gpx4抑制剂FIN56处理后软骨细胞代谢相关蛋白表达的改变;i-j:通过WB检测基因敲低Gpx4对软骨细胞代谢相关蛋白表达的影响。)
4.牛磺酸通过促进OGT依赖性O-GlcNAcylation缓解软骨细胞炎性损伤
为了验证OGT依赖性O-GlcNAcylation介导牛磺酸对炎性软骨细胞的保护作用。我们首先检测了轻度损伤OA患者软骨组织和重度损伤OA患者软骨组织中O-GlcNAc总蛋白和OGT蛋白的表达。结果发现重度损伤OA患者软骨组织中O-GlcNAc总蛋白和OGT蛋白的表达显著下降(图5a)。随后,我们发现在原代小鼠软骨细胞中,O-GlcNAc总蛋白,OGT蛋白以及Gpx4蛋白的表达均随着IL-1β处理浓度的增加逐渐下降(图5b)。此外,我们分别使用小分子药物OSMI和TMG来抑制/促进软骨细胞中的O-GlcNAc水平,结果发现抑制O-GlcNAc能够促进软骨细胞分解代谢并促进软骨细胞合成代谢,而促进O-GlcNAc表现出相反的效果(图5c)。表明O-GlcNAcylation可能参与软骨细胞代谢活动的调控。进一步的,我们在牛磺酸处理的基础上,分别使用OSMI和TMG来调节软骨细胞中O-GlcNAc水平。我们发现OSMI处理部分逆转了牛磺酸对软骨细胞的保护作用,而TMG处理进一步增强了牛磺酸对软骨细胞铁死亡的保护作用(图5d)。JC-1(图5e),脂质过氧化检测(图5f)和细胞亚铁离子检测(图5g)也进一步表明O-GlcNAcylation参与介导了牛磺酸对软骨细胞铁死亡的保护作用。由于O-GlcNAcylation受到O-GlcNAc糖基转移酶OGT的调控。因此,我们分别对OGT进行了敲低和过表达。结果发现与OSMI和TMG的效果一致,敲低OGT能够抑制软骨细胞中O-GlcNAcylation,从而部分逆转牛磺酸对炎性软骨细胞的保护作用(图6a),而过表达OGT则促进了软骨细胞中O-GlcNAcylation,并进一步增强了牛磺酸对炎性软骨细胞的保护作用(图6b)。
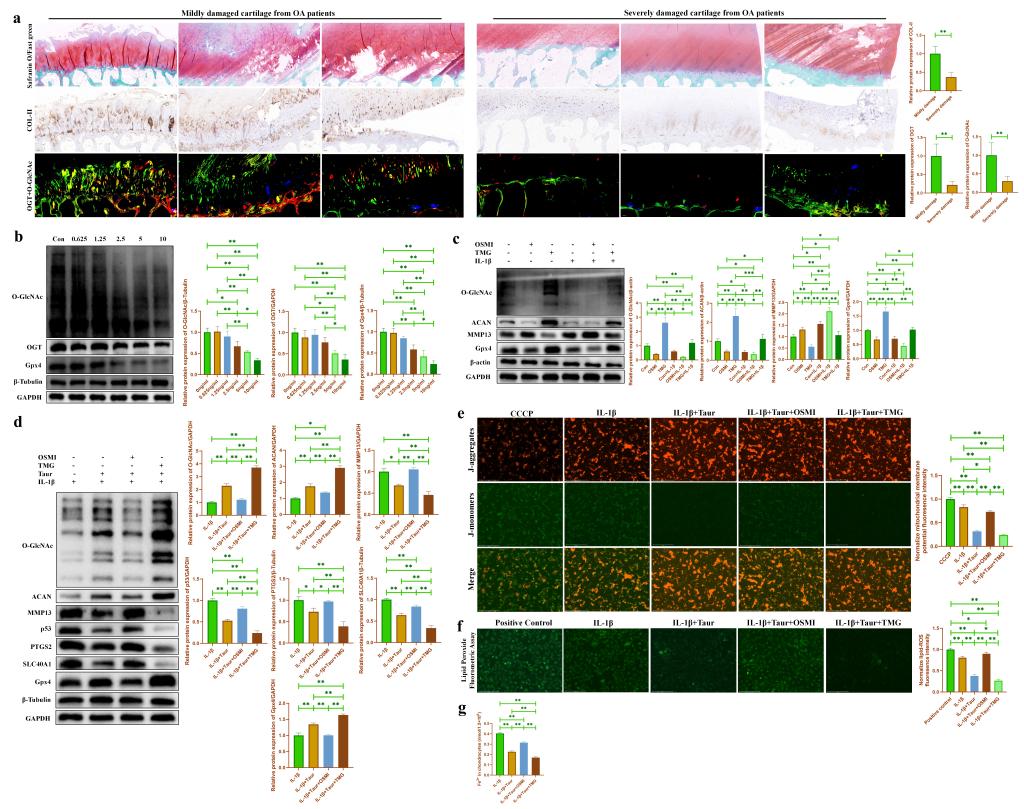
图5. 牛磺酸通过促进O-GlcNAcylation缓解软骨细胞炎性损伤。(a:轻度/重度损伤OA患者软骨组织的番红O固绿染色以及COL-II,O-GlcNAc(红色标记)和OGT(绿色标记)蛋白的免疫染色;b:通过WB检测不同浓度IL-1β处理后软骨细胞中O-GlcNAc 和OGT蛋白表达的改变;c:通过WB检测OSMI/TMG处理后的炎性软骨细胞中O-GlcNAc以及代谢相关蛋白表达的改变;d:通过WB检测在牛磺酸处理后,OSMI/TMG对炎性软骨细胞中O-GlcNAc以及代谢相关蛋白表达的影响;e:通过JC-1检测在牛磺酸处理后,OSMI/TMG对炎性软骨细胞中线粒体膜电位的影响;f:通过脂质过氧化物检测试剂盒检测在牛磺酸处理后,OSMI/TMG对炎性软骨细胞中脂质过氧化物的影响;g:通过亚铁离子比色检测试剂盒检测在牛磺酸处理后,OSMI/TMG对炎性软骨细胞中亚铁离子浓度的影响。)
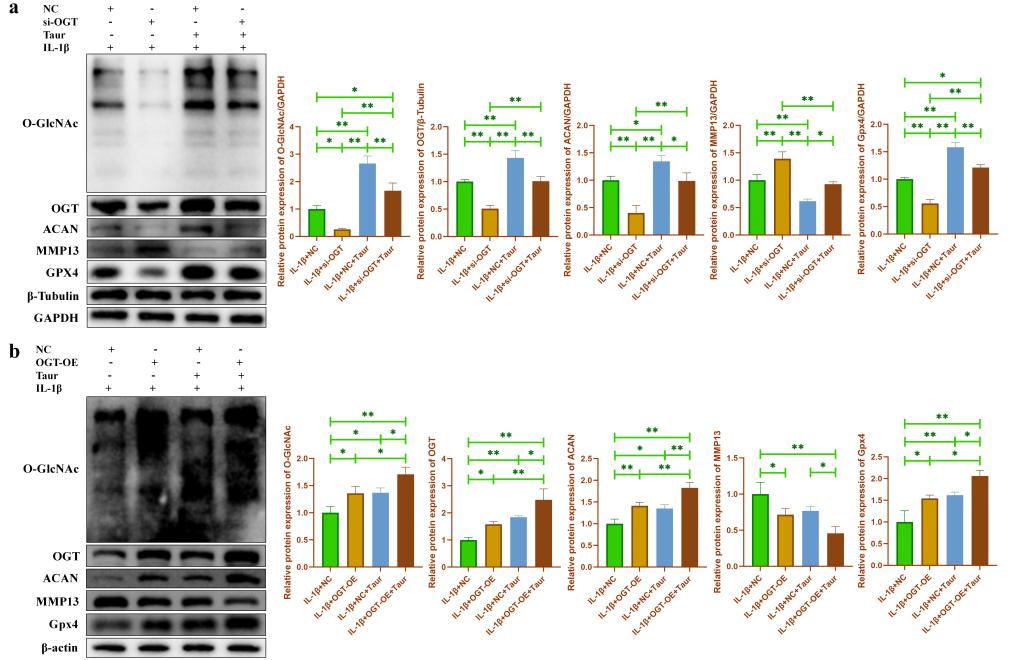
图6. OGT依赖的O-GlcNAcylation介导牛磺酸对炎性软骨细胞的保护作用。(a: 使用WB检测在牛磺酸处理后,敲低OGT对炎性软骨细胞代谢相关蛋白和Gpx4蛋白表达的影响;b:使用WB检测在牛磺酸处理后,过表达OGT对炎性软骨细胞代谢相关蛋白和Gpx4蛋白表达的影响。)
5.OGT促进Gpx4蛋白稳定性
由于O-GlcNAcylation是一种普遍存在的蛋白质翻译后修饰,我们猜测铁死亡的关键蛋白Gpx4可能具有O-GlcNAc修饰位点。我们首先使用CHX来阻断软骨细胞的蛋白质合成。我们发现,随着CHX处理时间的延长,Gpx4蛋白表达逐渐减少(图7a)。OSMI加速了Gpx4的降解(图7a),而TMG则抑制了Gpx4的降解(图7b)。与之一致的是,敲低OGT的表达会加速Gpx4的蛋白降解(图7c),而过表达OGT则会抑制Gpx4的蛋白降解(图7d)。此外,MG132处理进一步证明了O-GlcNAcylation可以促进Gpx4的蛋白稳定性(图7e-g),其潜在机制可能与抑制泛素化降解有关(图7h)。随后,我们通过免疫沉淀初步验证了Gpx4蛋白可能存在O-GlcNAcylation(图7i)。最后,免疫共沉淀(图7j-k)和免疫荧光(图7l)结果验证了OGT和Gpx4蛋白之间可能存在相互作用。上述结果表明,OGT依赖的O-GlcNAcylation可能通过抑制泛素化降解来稳定Gpx4的蛋白表达。
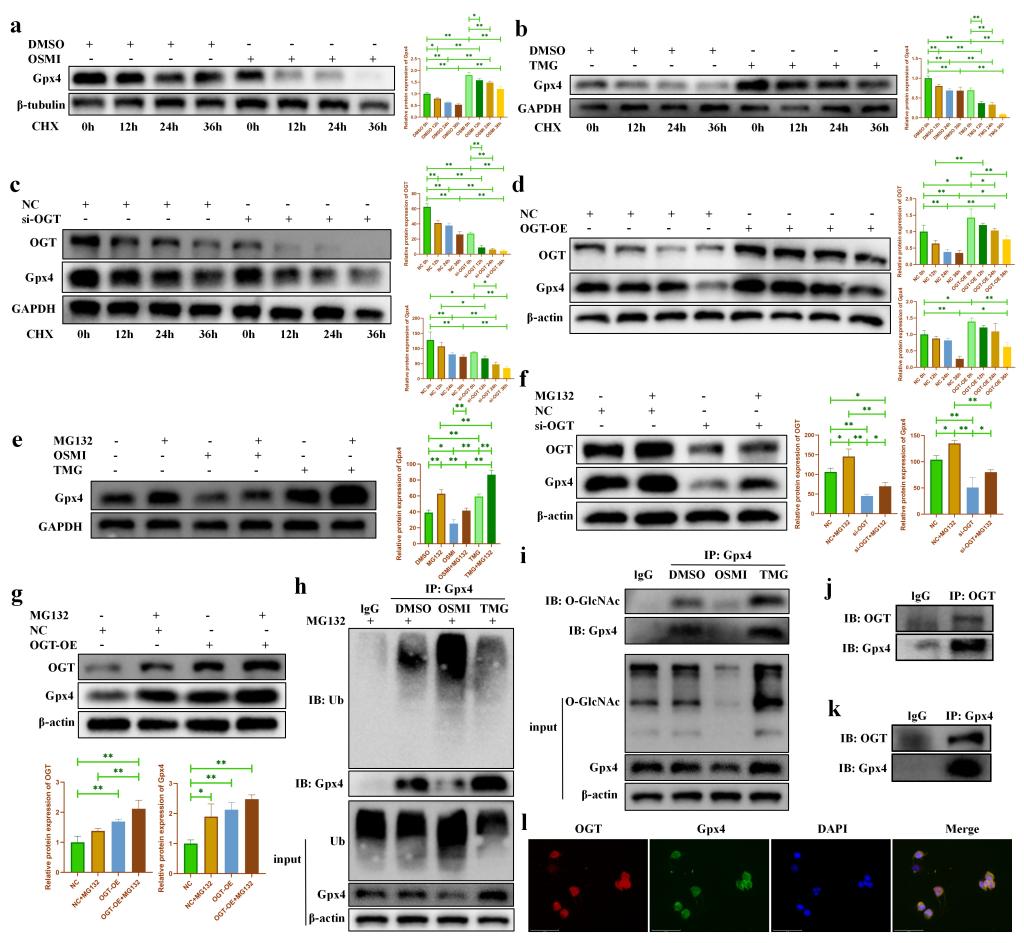
图7. OGT促进Gpx4的蛋白稳定性。(a-b:不同时间点 CHX(1μM)处理后,OSMI/TMG对Gpx4 蛋白降解的影响;c-d:不同时间点 CHX(1μM)处理后,敲低/过表达 OGT对Gpx4蛋白降解的影响;e:在MG132存在或不存在的情况下,OSMI/TMG对Gpx4蛋白降解的影响;f-g:在MG132存在或不存在的情况下,OGT 的敲低/过表达对Gpx4蛋白降解的影响;h:免疫沉淀实验表明Gpx4蛋白可能存在 O-GlcNAcylation;i-k:免疫共沉淀实验证明Gpx4蛋白与OGT蛋白之间可能存在相互作用;l:免疫荧光实验证明Gpx4蛋白与OGT蛋白之间可能存在相互作用。)
6.牛磺酸通过调控O-GlcNAcylation和铁死亡来缓解ACLT诱导的小鼠软骨退变
最后,我们通过动物实验验证O-GlcNAcylation和铁死亡参与介导了牛磺酸对软骨退变的保护作用。在这部分研究中,我们使用AAV-shRNA-Gpx4进行关节腔注射来抑制软骨中Gpx4蛋白的表达。此外,分别使用OSMI和TMG关节腔注射来抑制/促进软骨组织中的O-GlcNAcylation水平。所有小鼠均在ACLT术后八周后处死。HE和番红O固绿染色显示牛磺酸能够有效保护ACLT诱导的小鼠软骨退变(图8a-d)。COL-II是软骨基质中主要的胶原蛋白成分。我们发现牛磺酸能够有效缓解COL-II蛋白丢失。AAV-shRNA-Gpx4和OSMI关节腔注射均能够部分逆转牛磺酸的这一保护作用,而TMG处理并没有加重OA小鼠的软骨退变(图8e-f)。此外,我们还检测了软骨组织中O-GlcNAc总蛋白和OGT蛋白的表达。我们发现牛磺酸能够显著促进OA小鼠软骨组织中O-GlcNAc总蛋白和OGT的蛋白表达(图9a-b)。上述结果证明,O-GlcNAcylation和铁死亡参与介导了牛磺酸对ACLT小鼠软骨退变的保护作用。
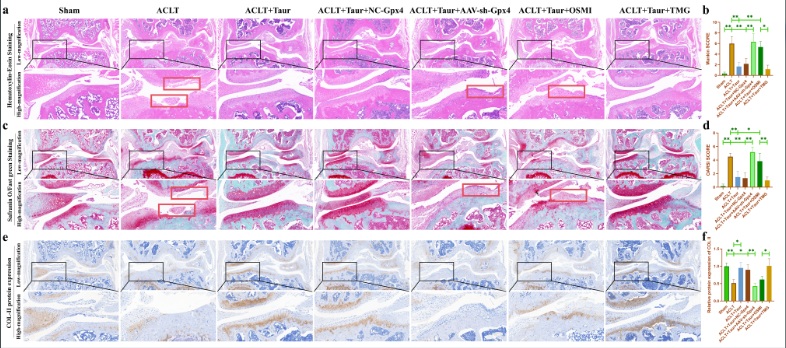
图8. 牛磺酸缓解ACLT小鼠的软骨退变。(a:小鼠膝关节的HE染色;b:小鼠膝关节的Mankin评分;c:小鼠膝关节的番红O固绿染色;d:小鼠膝关节的OARSI评分;e-f:通过免疫组化染色检测小鼠膝关节软骨中COL-II蛋白表达的改变。)
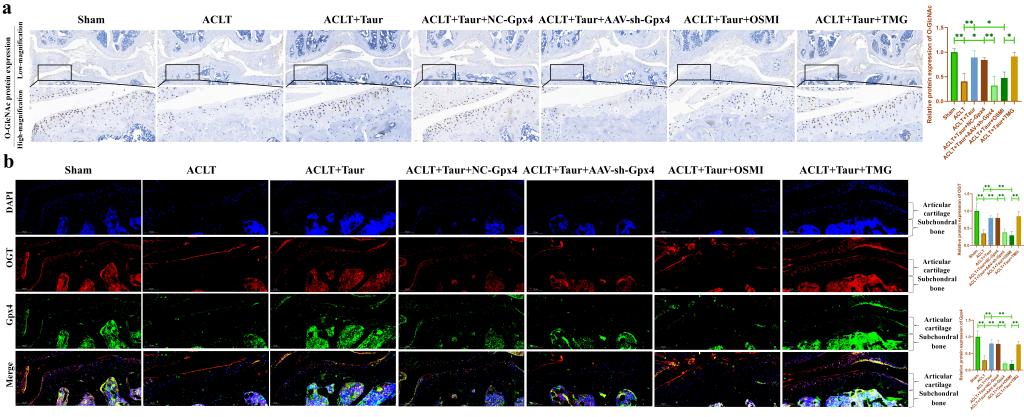
图9. O-GlcNAcylation和Gpx4参与介导牛磺酸缓解ACLT小鼠软骨退变。(a:通过免疫组化染色检测小鼠膝关节软骨中O-GlcNAc总蛋白表达的改变;b:通过免疫荧光染色检测小鼠膝关节软骨中OGT和Gpx4蛋白表达。)
研究结论
该研究通过对ACLT诱导的OA大鼠膝关节软骨细胞和血清进行代谢组学分析,确定了运动损伤继发OA病变中的特征性代谢分子牛磺酸。外源性添加牛磺酸能够显著缓解IL-1β诱导的软骨细胞炎症和氧化应激表型。生信分析结合多组学研究揭示,牛磺酸可能通过抑制Gpx4依赖的铁死亡和激活OGT依赖的O-GlcNAcylation来缓解IL-1β诱导的软骨细胞炎性损伤,并通过动物实验得到了进一步验证。由于牛磺酸是一种非常安全的氨基酸,常用于食品或药品添加剂,该研究结果有望为牛磺酸在运动损伤继发OA治疗中的转化研究和应用提供科学依据。
尽管该研究发现Gpx4依赖性铁死亡和OGT依赖的O-GlcNAcylation是牛磺酸保护软骨细胞炎性损伤/软骨退变的潜在机制。然而,免疫荧光、免疫沉淀和分子对接等技术并不能充分证明Gpx4和OGT之间可能存在直接相互作用。未来的研究可以采用更先进的技术,如联合免疫沉淀和高分辨率质谱分析,以明确明Gpx4和OGT之间是否存在直接的物理相互作用,亦或者是否通过中间分子和信号级联进行间接调控。此外,还需要更多的证据,包括表面等离子体共振和细胞热转移试验,以充分证明Gpx4与OGT蛋白之间存在直接相互作用。未来的研究还可以结合质谱和定突变技术来探索和验证Gpx4可能存在的O-GlcNAcylation位点。并结合定点突变技术构建 Gpx4基因敲除小鼠,以全面验证Gpx4在OA软骨退变中的功能。此外,虽然本研究侧重于牛磺酸对Gpx4和铁死亡的下游影响,但对OA中调节铁死亡的上游调节因子的探讨并不全面。未来的研究可以筛选出可能直接或间接影响 Gpx4表达和铁死亡激活的潜在上游激酶或转录因子。值得一提的是,尽管我们发现 O-GlcNAcylation 水平在 OA 软骨细胞中降低,但O-GlcNAcylation水平在OA增生滑膜组织中似乎是升高的(数据未展示)。O-GlcNAcylation在OA滑膜炎性组织中的调控作用有待进一步探讨,这是非常具有吸引力的研究方向。
原文链接:https://authors.elsevier.com/sd/article/S2090-1232(25)00029-3
倪国新教授:香港大学医学院博士,主任医师,教授,博士生导师,德国洪堡学者。现任厦门大学附属第一医院康复医学科主任。兼任中华预防医学会体育运动与健康分会副主任委员、中国老年医学会运动健康分会副会长、厦门市康复医师分会会长、厦门市体卫融合专家指导委员会主任委员等职务;受聘为Frontiers in Physiology(Q1)/Heliyon(Q2)杂志副主编;为40多种国际知名期刊特邀审稿专家,国家自然科学基金会评专家,科技部项目评审专家。主持澳大利亚长江奋进奖项目、德国洪堡研究基金课题、国家重点研发计划课题、国家自然基金、国家社科基金等国内外研究课题30余项。以第一作者和/或通讯作者发表SCI文章90余篇。为首批国家健康科普专家和首批国家卫生健康技术推广服务专家,健康报社“2021年度健康传播影响力人物”、“2023年科普专家库优秀审稿专家”和“2024年科普之光创作者”称号。