今天为大家分享一篇近期发表在生物材料学TOP期刊《Materials Today Bio》的研究,题目为“Highly efficient NIR-II photothermal therapy amplified ROS oxide breast tumor therapy by mesoporous gallium-enriched platinum nanomedicine”。在这篇文章中,研究团队首次提出了一种一步法制备表面修饰有PEG2000的介孔PtGa双金属材料(PtGaP),展示了其在近红外II(1064 nm)激光照射下,通过PTT和氧化疗法(OXT)的协同作用,有效抑制肿瘤生长的能力。本文的通讯作者是厦门大学附属第一医院张福星教授和中国科学院福建物质结构研究所王培园副研究员,第一作者是中国科学院福建物质结构研究所应昀菲硕士研究生和厦门大学附属第一医院苏永辉主治医师。

研究背景介绍
镓(Ga)是人体中的一种微量元素,通常以三价形式存在,其与铁(Fe)在离子半径、电离势和电子亲和力等方面有许多相似之处。由于这些化学性质上的相似性,生物系统往往无法区分FeIII和GaIII,这使得GaIII可以替代FeIII参与铁代谢,从而干扰其正常功能。尽管GaIII具有临床益处,但在生理条件下,它可能会形成低溶解度和生物利用度的氢氧化镓(Ga(OH)3),从而限制了其治疗效果。此外,直接接触游离的GaIII可能导致肾毒性、肾酸中毒和肾小球损伤等副作用。
GaII与FeII类似,可以作为芬顿试剂,在肿瘤细胞中通过生成活性氧(ROS)来诱导氧化疗法(OXT)。然而,由于血液循环缺乏特异性,GaII载体可能会因GaIII/GaII对的相对较低的氧化还原电位而发生提前生物氧化。这可能导致过量的过氧化氢产生,并对健康组织造成不良影响。为了解决这一问题,研究人员将目光转向了无定形Ga0纳米颗粒,这些颗粒设计为在酸性的肿瘤微环境中快速离子化,按需释放GaII,使得局部芬顿反应得以实现,为癌症治疗提供更精准的方法。该系统的刺激响应特性使治疗更加针对肿瘤部位。虽然单独使用OXT通常不足以达到最佳治疗效果,但将其与其他治疗方法结合使用通常能取得更好的疗效。
协同治疗在肿瘤抑制中已得到广泛应用。根据热力学分子碰撞理论,提高局部温度可以提升芬顿反应的效率,这使得光热治疗(PTT)成为理想的辅助治疗方法。铂(Pt)纳米粒子因其出色的纵向表面等离子体共振、抗光漂白性和体内生物相容性,特别是在近红外II波段(1000-1700 nm)的特异性吸收,使其特别适合用于PTT。因此,开发和优化镓(Ga)和铂(Pt)共掺杂的纳米粒子对乳腺癌治疗具有重要意义。这种方法结合了两种FDA批准的成分,对于推进纳米医学的临床应用至关重要。
针对上述关键问题,作者团队开发了一种Pt和Ga0双金属共掺杂材料。合成的PtGa具有独特的介孔纳米结构,因此比固体材料更大的表面积和更多的活性位点,同时这种纳米颗粒能够有效在乳腺肿瘤区域积累,因此成为一种有潜力的芬顿型催化剂。当使用NIR-II(1064 nm)激光照射时,PtGaP显示出高光热转换效率,局部热效应通过Ga0催化剂促进了ROS的放大。体外和体内研究均表明,这种双金属介孔纳米药物能够通过PTT和OXT的协同作用有效抑制肿瘤发生发展。所有这些发现都强调了基于Pt和Ga的纳米复合材料作为恶性乳腺癌消融的化学动力学纳米制剂的潜力。
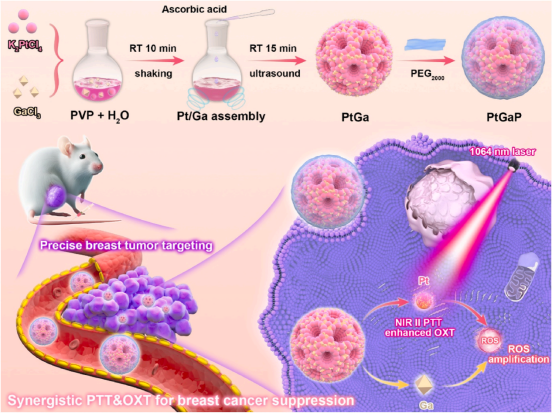
图 1 一步合成的介孔双金属PtGa纳米枝晶在1064纳米激光照射下,通过协同光热治疗(PTT)和光氧化治疗(OXT),精准靶向乳腺肿瘤并进行消融。
研究结果
介孔PtGaP的体外性能表征
介孔铂镓纳米颗粒通过一步溶液相反应制备,无需高温和有机溶剂。纳米颗粒使用PVP两亲性表面活性剂、K2PtCl4和氯化镓的金属共前驱体以及还原剂AA在室温下合成。PtGa纳米颗粒分散性良好,平均尺寸约为20纳米(图2A)。由于其独特的介孔纳米结构,PtGa的比表面积通过氮气吸附-脱附等温线测定为383.2 cm³/g。为了延长血液中的循环时间,进行了表面PEG化处理(PtGaP)。正是由于这种具有大比表面积的独特介孔纳米结构,PEG2000分子能够物理吸附到PtGa的表面。电子透射电子显微镜(TEM)图像显示,PtGaP的分散性更好,形态变化明显(图2B)。进一步观察放大TEM和高分辨率TEM(HRTEM),发现每个纳米颗粒的外表面和内表面均形成了平均直径~3纳米的介孔(图2C和D)。根据[55]的先前研究,这些双金属纳米颗粒是由空间互连的臂组装而成。最后通过高分辨率扫描透射电子显微镜(HR-STEM)、高角度环形暗场显微镜(HAADF)和元素映射图像显示,Ga、Pt、O在PtGaP纳米颗粒中均匀分布(图2E和F)。随后,ICG分子成功加载到堆叠的介孔中(PtGaP@I),其负载效率被定量确定为19.22 ± 2.03 %。显然,PtGaP@I中可以成功检测到ICG的吸收峰(780 nm),这表明它可以用作NIR-II(1000–1700 nm)的生物成像对比剂(图2M)。此外,通过NIR-II荧光生物成像系统进一步测量了ICG和PtGaP@I在水中的光稳定性。结果显示,游离ICG在连续光照18分钟后,其初始荧光强度减少了~92.3 %。相比之下,PtGaP@I在照射结束时,几乎保留了87.8 %的初始信号强度(图2I和J)。这些数据表明,堆叠的介孔能够显著稳定ICG染料,防止水分子淬灭,证实了PtGaP@I可以作为NIR-II荧光造影剂使用(图2G)。
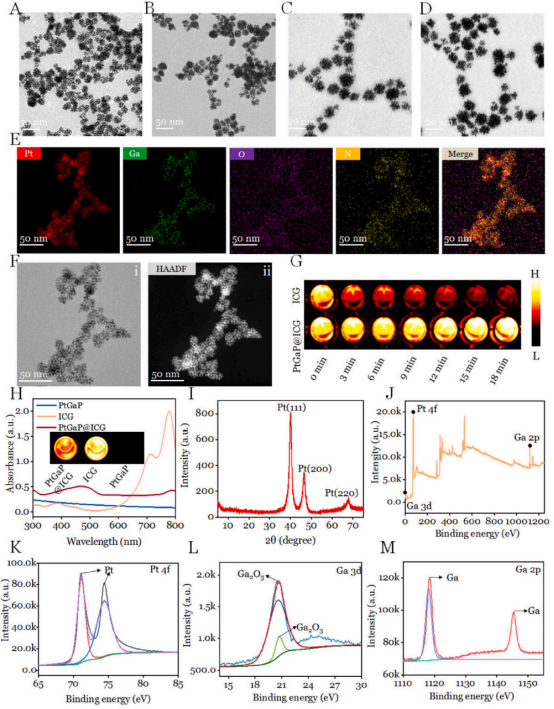
图 2 (A) PtGa和(B) PtGaP的透射电子显微镜图像。(C) PtGa和(D) PtGaP的高分辨率透射电子显微镜图像。(E)Pt、Ga、O、N元素的分布图及其合并图像,(F)PtGa和(G)PtGaP的高分辨率透射电子显微镜图像。(G)通过808纳米激光连续照射不同时间后ICG(上)和PtGaP@I(下)的近红外II荧光图像。(H)PtGa、ICG和ICG PtGaP@I的吸收光谱及近红外II发光图像(插图)。(I)PtGaP的XRD谱图。(J)全XPS高分辨率图谱,包括(K) Pt 4f、(L) Ga 3d和(M) Ga 2p的光谱。
介孔PtGaP的ROS生成能力和NIR-II PTT能力验证
鉴于Ga0和Fe0的相似性,使用3,3,5,5-四甲基联苯胺(TMB)在体外测定PtGaP介孔纳米结构产生的•OH。TMB的氧化产物(oxTMB)在645 nm处显示出强烈的吸收(蓝色)。活性氧的生成效率对PtGaP和过氧化氢有明显的剂量依赖性(图3A和B)。并且反应非常迅速,在大约15分钟内达到峰值(图3C)。异丙醇(IPA)是一种已知的•OH清除剂,当PtGaP与2.0 mg/mL的过氧化氢结合时,生成的oxTMB的吸收峰显示出明显的IPA浓度依赖性(图3D)。与非NIR-II激光对照组相比,PtGaP +过氧化氢加1064 nm激光照射组的•OH生成量增加了2.4倍,强烈表明纳米载体在癌细胞胞浆中具有强大的协同活性氧放大作用(图3E)。
进一步使用红外相机测量了PtGaP在1064 nm NIR-II激光照射下的升温曲线。与对照组组(0 μg/mL)相比,后者显示的温度变化最小,PtGaP的温度升高与其浓度有关(图3F)。具体而言,0.8 mg/mL PtGaP溶液在NIR-II激光照射下5分钟内最大温差(△T)达到22.3◦C,证实了PtGaP对NIR-II光的快速响应(图3G)。为了进一步研究其对1064 nm激光的响应,实验中应用了不同的功率密度,结果显示,随着功率密度的增加,200 mg/mL PtGa溶液的温度显著升高(图3H和I)。此外,PtGaP在四个激光开关循环中表现出优异的光稳定性(图3J)。为了定量评估激光到热量转换效率(η),分析了加热/冷却循环(激光开关)期间的热变化(图3K)。根据已建立的公式,计算出PtGaP的η约为43.11 %。综上所述,这些结果突显了介孔PtGa纳米平台作为NIR-II激光诱导光热增强OXT的有前景的纳米药物的潜力。
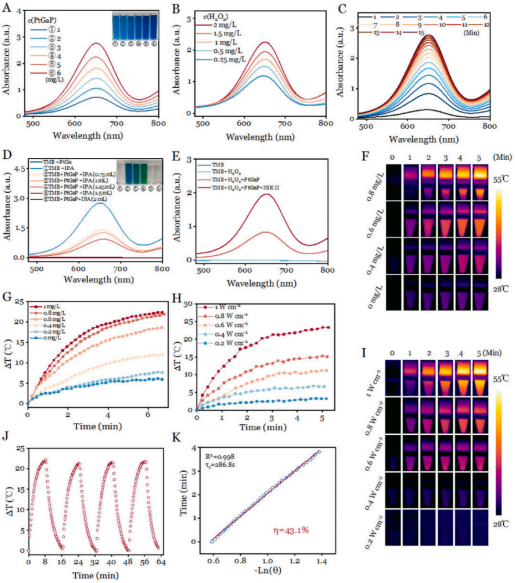
图 3 (A)紫外-可见吸收光谱和数码照片(插图)展示了在不同浓度的PtGaP存在下,TMB与0.5 mg/L过氧化氢共孵育后生成的oxTMB。(B)TMB在与PtGaP(3 mg/L)及不同过氧化氢剂量孵育后随时间变化的吸收光谱。(C)TMB在与PtGaP(3 mg/L)及过氧化氢(0.5 mg/L)孵育不同时间后的紫外-可见吸收光谱。(D)TMB在与不同配方及各种浓度的IPA孵育后的紫外-可见吸收光谱和数码照片(插图)。(E)经过不同处理后的紫外-可见吸收光谱。(F)不同浓度的PtGaP在1064 nm激光照射5分钟后,红外热成像和温度变化曲线。(G)不同功率密度下,PtGaP在1064 nm激光照射下的温度变化曲线和红外热成像。(H)PtGaP在四个激光开/关循环中的温度变化。(K)冷却时间和-Ln(θ)之间的线性关系。
介孔PtGaP在细胞水平上的性能评价
在这项研究中,作者团队首次开发了介孔PtGaP纳米药物,因此需要评估其对正常细胞和肿瘤细胞的生物相容性。随着浓度的增加,PtGaP在治疗12小时后对4T1细胞的细胞毒性显著增强。当浓度达到100 μg/mL时,4T1细胞的存活率仅为39 %,而正常胃黏膜上皮细胞(GES-1)的存活率是4T1细胞的两倍(图4A)。这表明纳米药物具有针对肿瘤细胞的特异性杀伤作用。此外,进一步研究了PtGaP、磷化镓和PtP在连续NIR-II激光照射(5分钟,1 W/cm²)下对肿瘤细胞(过氧化氢预处理)的细胞杀伤效果。如图4B所示,PtGaP + L组的存活率显著低于仅接受PtGaP治疗的组。值得注意的是,在300 μg/mL和400 μg/ mL的浓度下,4T1细胞的存活率分别仅为27 %和14 %。
为了更清晰地观察PtGaP在细胞内的分布,我们使用FITC染料(激发波长488纳米,发射波长550纳米)对这种介孔纳米结构进行了标记。随后,通过CLSM和流式细胞术评估了4T1细胞对PtGaP的摄取效率。值得注意的是,随着时间的推移,细胞质中的绿色信号逐渐增强,证实了PtGaP的内吞作用是时间依赖性的(图4F)。流式细胞术的结果与CLSM观察结果一致,显示了类似的时间依赖性模式,内吞作用在4小时时达到饱和(图4E和C)。
此外,作者团队通过定性评估PtGaP孵育4小时后细胞内的ROS水平进一步探索了肿瘤细胞破坏的潜在机制。首先,细胞被随机分为八个组(图4D)。经过不同的处理后,使用商用指示剂2′,7′-二氯荧光素二乙酸酯(DCFH-DA,激发波长488 nm,发射波长550 nm)测量细胞内的ROS生成。随后通过流式细胞术和CLSM量化细胞的荧光强度。如图4G所示,对照组和PBS + L组的荧光水平相似,而PtGaP处理的细胞显示出大约四倍的ROS生成。值得注意的是,预孵育100 μM过氧化氢的PtGaP+L处理的肿瘤细胞中的胞浆ROS水平比仅PtGaP组高出2.7倍,强烈证实了在NIR-II激光照射下肿瘤微环境中增强的OXT效应。正如预期,用PtGaP +过氧化氢加1064纳米激光照射处理的肿瘤细胞显示出最强的绿色信号,比PtGaP +过氧化氢和PtGaP + L组更为显著(图4H)。这些结果共同证实,新型PtGaP纳米药物能够被肿瘤细胞有效内化,并在近红外II光照射和高过氧化氢条件下通过强大的活性氧生成触发细胞死亡。
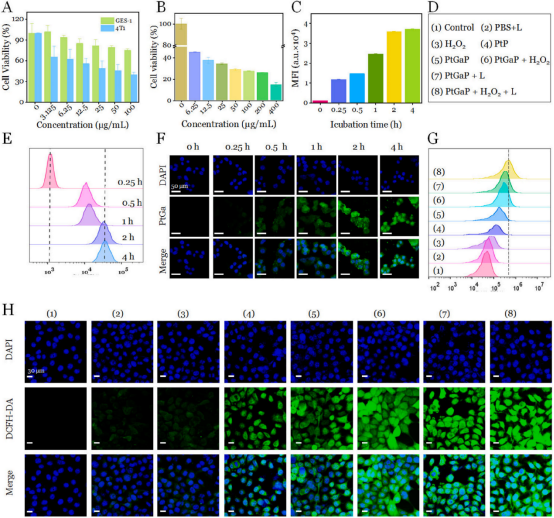
图 4 (A)各种浓度的PtGaP处理12小时后,4T1和GES-1细胞的存活率。(B)经PtGaP、NIR-II激光照射和过氧化氢处理后的4T1细胞存活率。(C)4T1细胞在不同时间点与PtGaP孵育后的平均荧光强度。(D)细胞分组用于ROS生成研究。(E)通过流式细胞术分析,(F)通过共聚焦激光扫描显微镜(CLSM)分析,4T1细胞在不同时间点与PtGaP(用FITC标记)孵育后的变化。(G)通过流式细胞术分析,(H)通过共聚焦激光扫描显微镜(CLSM)分析,4T1细胞在八种不同处理后的细胞质ROS水平。
线粒体是重要的细胞器,其损伤可以直接触发线粒体的内在凋亡途径。为了研究PtGaP引起的线粒体功能障碍,作者团队首先使用JC-1染色评估线粒体膜电位(图5A和B)。在孵育4小时后,对照组、PBS组和过氧化氢组的4T1细胞未显示出显著的绿色荧光(表明线粒体受损),而红色荧光则非常丰富(表明线粒体正常)。相比之下,PtP、PtGaP和PtGaP +过氧化氢处理后,红色荧光消失,绿色荧光增加(细胞质中的单体增多)。值得注意的是,PtGaP + L +过氧化氢组的绿色信号显著增强,表明线粒体功能障碍最为严重,与PtGaP +过氧化氢组相比,聚集体与单体的比例降低了2.5倍(图5C)。进一步的流式细胞术分析显示,JC-1染色的4T1细胞中存在线粒体特异性的OXT触发损伤(图5F)。在PtGaP +过氧化氢组中,使用1064纳米激光照射后,线粒体膜功能障碍的聚集体与单体比例比PtGaP +过氧化氢组高出2.3倍。这些流式细胞术结果与CLSM成像观察到的趋势高度一致。鉴于细胞活力研究中观察到的显著细胞死亡率,使用CLSM捕捉活/死细胞的绿色/红色荧光以区分细胞状态。如图5D和G所示,PBS组和仅激光组未检测到明显的损伤。令人惊讶的是,PtGaP + H2O2+L组中仅有11 %的细胞存活,与PtGaP +过氧化氢组相比,癌细胞死亡率增加了近3.3倍。这表明,虽然OXT具有一定的细胞消除能力,但近红外II型光热治疗(NIR-II PTT)诱导的OXT放大显著增强了细胞死亡。此外,凋亡/坏死分析显示,PtGaP诱导的死亡率较低,大约20 %的细胞发生凋亡(图4E-H),进一步证明了其出色的生物相容性。所有这些发现表明,基于PtGaP的纳米平台与激光照射结合使用,可以特异性地在高过氧化氢条件下协同抑制癌细胞增殖,使PtGaP成为一种有前途的NIR-II PTT/OXT纳米剂,用于临床乳腺癌治疗。
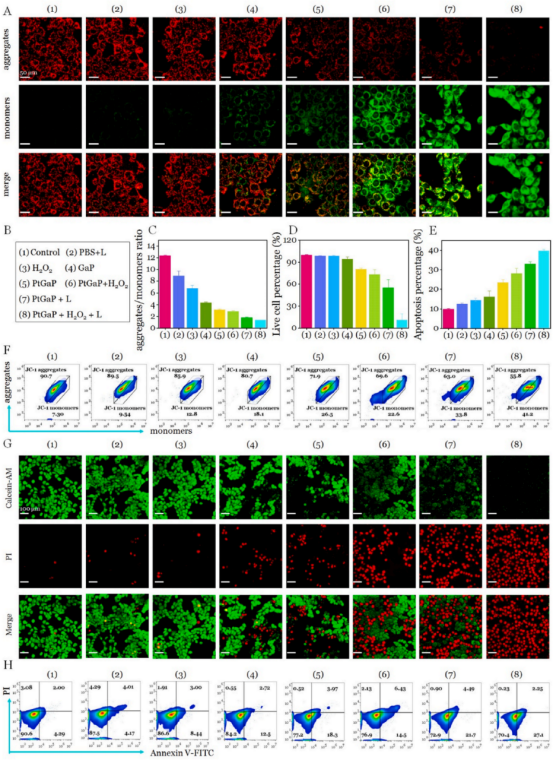
图 5 (A)经八种不同处理后,JC-1染色的4T1细胞的CLSM图像。(B)细胞分组:用于JC-1染色、CLSM成像和流式细胞术分析的细胞分组。(C)各种处理后,JC-1染色的4T1细胞的聚集体与单体比例。(D)不同处理后4T1细胞中活细胞的比例。(E)不同处理后4T1细胞的凋亡百分比。(F)不同处理后,JC-1染色的4T1细胞的流式细胞术分析。(G)经八种配方处理后,4T1细胞的活/死细胞的CLSM图像。(H)不同处理后4T1细胞的流式细胞术分析。
介孔PtGaP的体内靶向能力和NIR-II PTT评价
受到PtGaP在体外肿瘤细胞识别和治疗诊断潜力的启发,作者团队旨在研究这种纳米平台在体内的成像特性。作者团队通过NIR-II荧光成像技术,在携带4T1乳腺肿瘤的Balb/C小鼠中评估其生物分布和肿瘤靶向效果。如图6A所示,小鼠静脉注射自由ICG或PtGaP@I后,使用小型动物成像系统进行成像。荧光信号在肿瘤部位逐渐累积,在注射后3小时达到峰值。48小时时,肿瘤区域(用虚线圈标出)清晰可见,信号逐渐减弱,到72小时时变得微弱。相比之下,对照组中自由ICG在肿瘤部位的荧光几乎可以忽略不计,即使在240小时后也是如此。正如预期,PtGaP@I组的肿瘤相关性(TNR)显著高于仅使用ICG的组(图6B)。值得注意的是,注射后48小时,PtGaP@I组的TNR最高,几乎是ICG组的16.5倍。此外,注射后24小时的离体NIR-II荧光成像显示,与ICG组相比,PtGaP@I组的实体乳腺肿瘤表现出最高的肿瘤积累和最少的网状内皮系统(RES)器官摄取(图6C和D)。基于这些发现,进一步测量了两组在1064纳米光照射下,注射PtGaP@I和ICG后48小时的局部肿瘤温度。在PtGaP@I组中,温度迅速上升,在连续NIR-II照射5分钟后达到约60◦C的峰值。相比之下,ICG处理组在相同条件下仅表现出~41◦C的温度升高(图6E和F)。由于精确的肿瘤靶向和最小的RES吸收,PtGaP@I纳米药物缓解了对潜在系统毒性的担忧。虽然50◦C以上的温度对肿瘤消融有效,但不会对周围正常组织造成显著损害。与用于乳腺癌治疗的其他铂基纳米粒子相比,PtGaP纳米平台凭借其精准的肿瘤蓄积能力,可实现肿瘤诊断的增强和协同治疗的有效性。
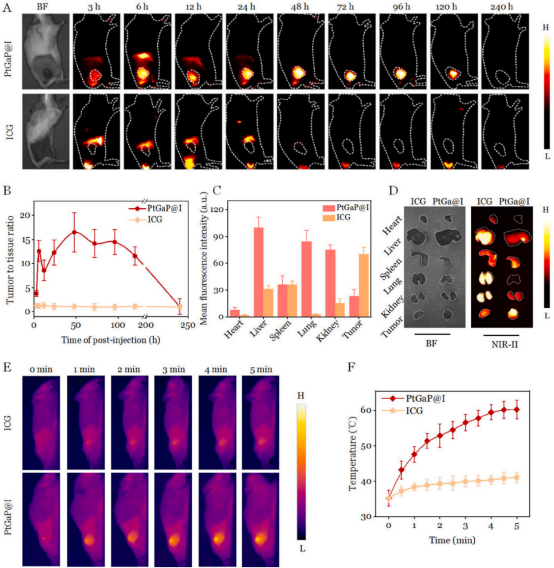
图 6 (A)不同时间点通过静脉注射PtGaP@I或ICG处理的小鼠乳腺肿瘤模型的近红外二区(NIR-II)荧光成像结果,虚线圆圈标记肿瘤部位。(B)基于(A)生成的TNR数据。(C)PtGaP@I和ICG处理小鼠注射后24小时主要器官及肿瘤的定量荧光强度与离体荧光图像。(E)PtGaP@I或ICG注射48小时后,经1064 nm光照5分钟的乳腺肿瘤小鼠热成像图及(F)温度升幅曲线。数据以均值±标准差表示(n=5)。
介孔PtGaP的体内协同NIR-II PTT&OXT
基于作者团队研发的PtGaP纳米平台在体外细胞杀伤能力和肿瘤富集特性,研究人员建立了4T1肿瘤异种移植小鼠模型,以进一步评估NIR-II光热/光氧化疗法与PtGaP的体内协同治疗效果。为验证治疗假设,对皮下植入骨肉瘤的小鼠分别使用四种不同制剂(PBS、PBS + L、PtGaP、PtGaP + L)进行治疗。如图7A-D所示,PBS组和PBS+1064 nm激光治疗组在整个治疗期间肿瘤生长迅速,表明1064 nm激光(5分钟,1.0W/cm²)对抑制肿瘤的作用微乎其微。相比之下,PtGaP治疗组表现出更显著的抑瘤效果,其肿瘤体积和重量均明显优于PBS组。值得注意的是,PtGaP + L组几乎完全抑制了肿瘤生长,其肿瘤增长率显著低于其他组别(图7E)。这种增强的清除效率可归因于1064 nm光照下光热诱导的活性氧(ROS)扩增产生的协同效应。肿瘤组织最终通过H&E染色、TUNEL检测和Ki67抗体染色进行分析。如图7G所示,PtGaP + L组的H&E染色显示细胞核染色质高度凝聚,坏死肿瘤细胞区域最大。TUNEL免疫组化分析表明,该组细胞凋亡和坏死细胞数量较其他组显著增加。此外,作为广泛认可的细胞增殖标志物,PtGaP + L组的Ki67表达量明显降低,进一步证实了基于PtGaP的光热/光氧化协同疗法在近红外II型光照射下取得的优异肿瘤抑制效果。各组小鼠体重变化幅度极小,经PtGaP纳米平台联合激光治疗的小鼠主要器官均未观察到显著组织病理学异常(图7F)。因此,本研究中低剂量镓掺杂不会产生毒性问题。
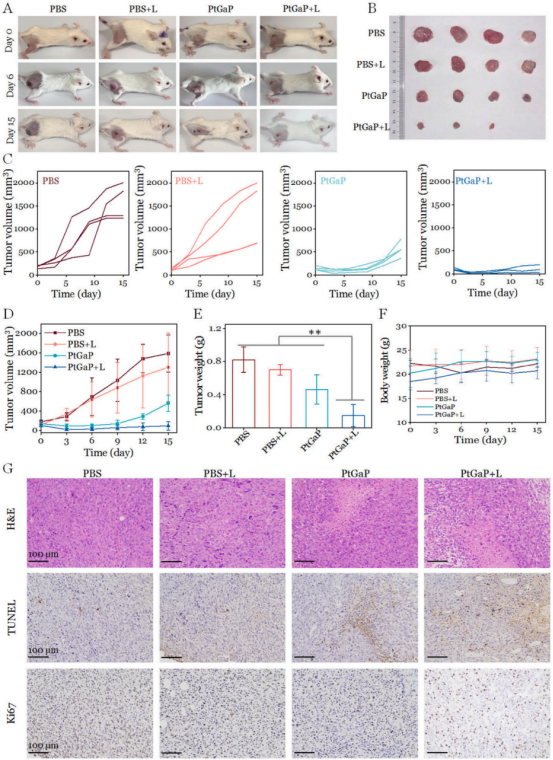
图 7 (A)经不同治疗15天后携带乳腺癌的小鼠具有代表性的数码照片。(B)各治疗组切除肿瘤15天后的照片。(C)PBS、PBS + L、PtGaP及PtGaP + L治疗组小鼠个体肿瘤生长曲线。(D)不同治疗组的肿瘤体积变化曲线及(F)体重变化情况。(E)各治疗组切除肿瘤15天后的重量数据。(G)不同治疗组切除肿瘤15天后的H&E染色、Ki67标记及TUNEL检测结果。**p < 0.01,标准差(n = 4,均值±标准差)。
结论
综上所述,作者团队通过一步溶液相反应成功制备出具有单分散直径的介孔PtGa纳米剂,经表面聚乙二醇化处理后,PtGaP纳米药物不仅展现出源自铂基(Pt)的优异近红外II波段光热转换性能,还通过镓基(Ga)催化剂实现了显著的类芬顿催化活性。凭借精准的肿瘤细胞靶向性和优越的形貌特征,在近红外II波段光照下,通过热激活可触发大量活性氧(ROS)生成。在体外和体内实验中,该纳米平台通过光热协同效应(OXT)与近红外II波段光热治疗(PTT)的组合,在1064 nm光照射条件下展现出显著的肿瘤杀伤效果。
本研究提出的纳米平台为协同应用光热与近红外II波段光热疗法提供了一种创新性解决方案,可有效抑制恶性肿瘤生长。
原文链接:www.journals.elsevier.com/materials-today-bio
通讯作者简介

张福星,厦门大学附属第一医院院长,主任医师,教授,博士生导师,厦门市本土领军人才。中国医师协会外科医师分会委员,中国医促会理事、外科学分会常委兼副秘书长,全国卫生产业企业管理协会疝和腹壁外科产业及临床研究分会常务理事兼第26专家组组长,世界内镜医师协会疝和腹壁外科协会常务理事,内镜临床诊疗质量评价专家委员会委员,中国研究型医院学会甲状腺疾病专业委员会委员,福建省医学会外科学分会常委,福建省海峡肿瘤防治科技交流协会常务理事兼甲状腺肿瘤分会主任委员,福建省医师协会普通外科医师分会腔镜甲状腺学组副组长,海峡两岸医药交流协会台海医学会常委,厦门市医学会甲状腺外科学分会主任委员。担任《中华疝与腹壁外科杂志》编委,《中华内分泌外科杂志》编委。

王培园,中国科学院福建物质结构研究所,副研究员,2017年于复旦大学化学系获得博士学位。2018年加入中国科学院福建物质结构研究所。主要从事近红外二区荧光探针的制备和肿瘤微环境响应性荧光成像导航肿瘤的精准切除。主持国家自然科学基金青年项目。近年来在Nature Communications, Journal of the American Chemical Society, Angewandte Chemie International Edition, Advanced Functional Materials, ACS Nano等国际顶级期刊发表50余篇SCI论文。
第一作者简介

应昀菲,南华大学2022级生物学研究生,导师中国科学院福建物质结构研究所王培园副研究员,硕博在读期间以第一作者/共同第一作者在ACS Nano、Adv. Functional Materials、ACS Materials Letters、Materials Today Bio等国际权威期刊发表研究论文多篇,多次获得研究生国家奖学金。

苏永辉,厦门大学附属第一医院乳腺外科,主治医师,医学博士。毕业于复旦大学上海医学院,师从国内著名乳腺外科专家吴炅教授。福建省及厦门市高层次人才(C类)。现任福建省海医会乳腺肿瘤微无创分会青委会委员,福建省海峡肿瘤防治交流协会乳腺肿瘤防治分会青委会委员,厦门市医学会乳腺病学分会委员,厦门市抗癌协会乳腺癌专业委员会委员。主持国家自然科学基金项目一项,福建省自然科学基金项目一项。以第一作者/通讯作者在Materials Today Bio、Journal of Translational Medicine、npj Breast Cancer、The Breast、CANCER、The Oncologist等国际权威期刊发表多篇论著。