厦门大学附属第一医院临床研究伦理审查申请指引
初始审查文件递交注意事项
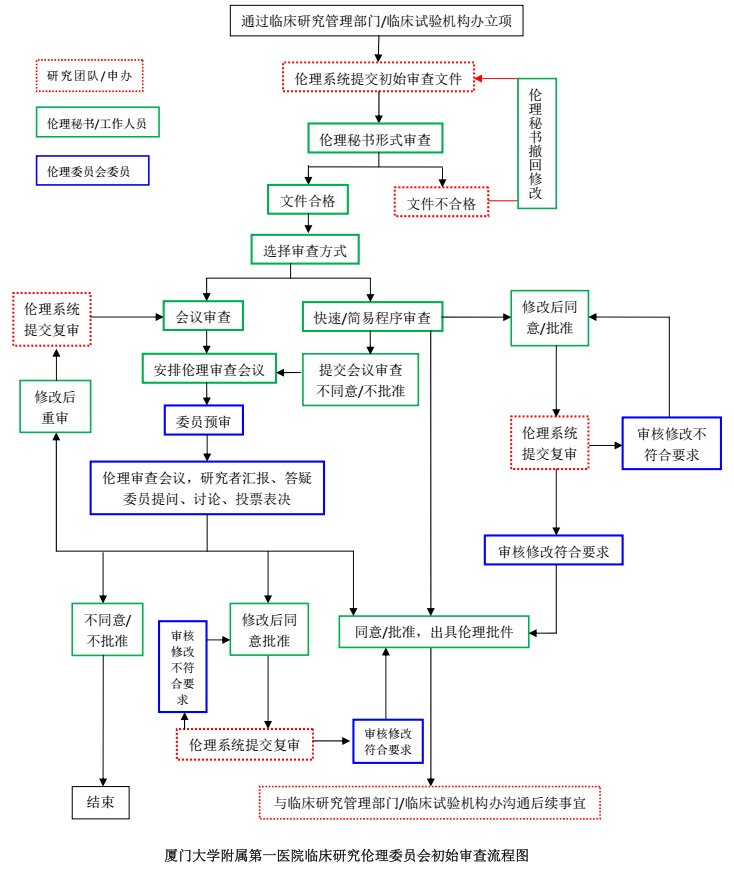
研究项目经本单位临床研究管理部门/临床试验机构办受理/立项后,需在伦理审查系统(https://www.xddyec.com:90/)创建待递交的项目,且所有需递交伦理委员会的文件均通过系统提交,具体的注意事项及操作流程详见《厦门大学附属第一医院伦理系统使用注意事项》,若希望尽量避免递交文件的回退修改,提交文件前请参阅《厦门大学附属第一医院伦理审查核心要点及提示》(均可从本单位官网下载)。
上传至伦理审查系统的文件,涉及签字盖章的请确保均已签字盖章,在系统中填写的表单除外。
除特殊情况外,设有组长单位的多中心项目,递交项目资料时需附组长单位审查意见;需国家药品监督管理局药品审评中心/医疗器械技术审评中心审批或与之沟通交流的项目,递交初始审查资料时需附相应批准通知书或沟通交流回复函。上述资料若不能与初始审查文件一起递交,请附相关说明文件,并最迟于项目启动前递交伦理委员会备案或审查(国家局/组长单位有建议或意见的)。
伦理秘书系统受理项目资料后,申请人自伦理审查系统下载打印伦理审查申请表,待主要研究者签名后将文件扫描上传至伦理审查系统,秘书核对后确认提交即进入审查流程。
厂家发起的初始审查项目需递交整套送审文件的纸质版存档,其他审查类别无需递交纸质版。递交初始审查纸质版资料时,请同时递交一个已存入从伦理审查系统下载的整套初始审查送审文件的移动硬盘作为后续保存项目电子版文件的媒介至医学伦理办公室保存,后续需定期(一般参照定期跟踪审查频率)将系统产生的项目电子版文件保存至移动硬盘。首次递交移动硬盘时,移动硬盘请以伦理项目号及主要研究者科室、姓名进行命名,硬盘外部也需做好相应标识。非厂家发起的临床研究均无需递交纸质版伦理审查文件。
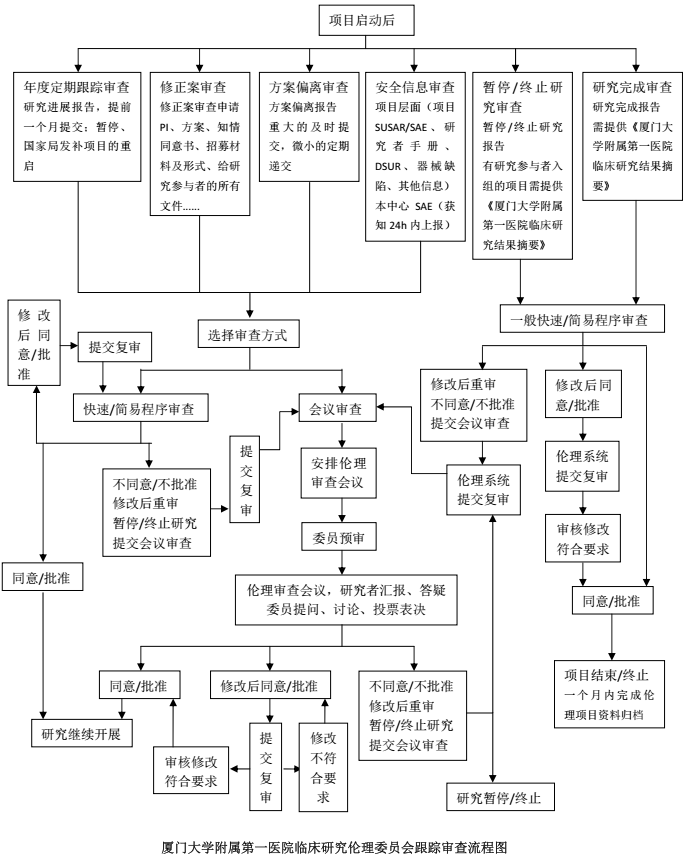
伦理委员会会议审查日期及会议相关工作通知将通过本单位官网及伦理微信群及时发布,项目授权人员也可通过伦理审查系统实时关注待审查项目的处理流程。
会议审查3个工作日前伦理秘书确认提交的项目一般可上最近的伦理审查会议。本单位一般2-3周召开一次临床试验伦理审查组审查会议,并视项目数及时加开伦理审查会议,时间一般是周三下午。
医学伦理办公室形成伦理审查决定后3个工作日内,以电子版“伦理审查批件”或“伦理审查意见”的方式传达审查决定,主要研究者及项目授权人员可以通过伦理系统查阅、下载伦理审查决定。会议审查后3-4个工作日即可通过伦理审查系统查看伦理审查决定。
需缴纳伦理审查费用的项目(初始审查、初始审查后需修改后重审、修正案审查),请在收到《伦理审查费通知单》后按要求在客户附言栏备注伦理受理编号进行打款,并将汇款凭证上传至伦理系统“费用凭证”处,待财务科开具发票后可在伦理系统“费用凭证”项下下载电子版发票,发票相关事宜可联系林嘉婕老师。
伦理秘书联系地址及电话:吴秀敏、林美玲(0592-2137569,鸿泉大厦1203室),林嘉婕、曹伟(0592-2139562,鸿泉大厦1212室)。